- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Бактериологическое исследование молока и секрета вымени коров презентация
Содержание
- 1. Бактериологическое исследование молока и секрета вымени коров
- 2. Возбудителями острых гнойных и хронических маститов являются:
- 3. Взятие материала Материал (молоко)отбирают из пораженных долек
- 4. Лабораторная диагностика секрета вымени Исследуемый материал Посев
- 5. Оценка результатов исследования При появлении роста на
- 6. Рост стафилококков на кровяном агаре и желточно-солевом агаре Чистовича
- 7. Лабораторная диагностика стафилококков 1этап)Учет результатов первичного посева
- 8. Определение продукции ПЛАЗМОКОАГУЛАЗЫ ЛЕЦИТОВИТЕЛЛАЗЫ
- 9. Морфология энтерококков. Характер роста на энтерококкагаре Enterococcus faecalis Enterococcus faecium
- 10. Лабораторная диагностика энтерококков Подтверждение принадлежности выделенных
- 11. Изучение способности энтерококков редуцировать
- 12. Характер роста стрептококков на кровяном агаре α-гемолитический стрептококк β-гемолитический стрептококк
- 13. Микробиологические методы идентификации микробов семейства стрептококковых Просмотр чашек с посевами
- 14. Лабораторная диагностика стрептококков При наличии подозрительных в
- 15. Лабораторная диагностика эшерихий 1-й день
- 16. Лабораторная диагностика 2-й день исследования
- 17. Лабораторная диагностика 3-й день исследования Идентификация чистой культуры по биохимическим признакам
- 18. Пробу молока засевают в пробирки со средой
- 19. Рост на средах 4 типа колоний
- 20. Рост на средах На среде Эндо
- 21. Рост на хромагенно- дифференциальных средах На
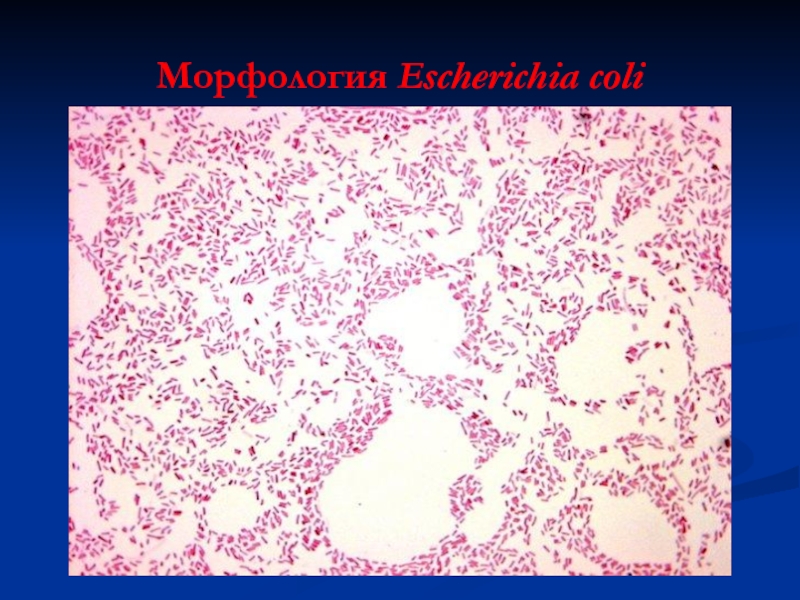
- 22. Морфология Escherichia coli
- 23. Схема бактериологического исследования на синегнойную палочку
- 24. Оксидазная активность Бактерии рода Pseudomonas
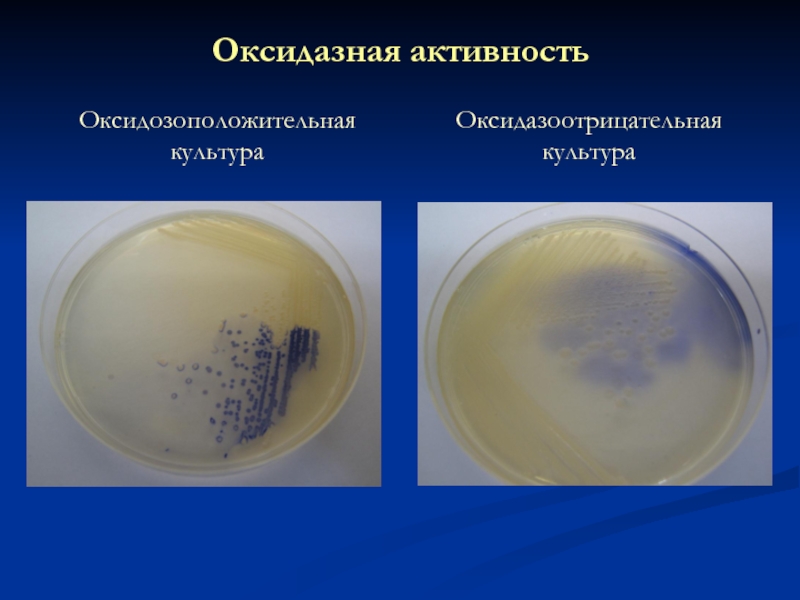
- 25. Оксидазная активность Оксидозоположительная культура Оксидазоотрицательная культура
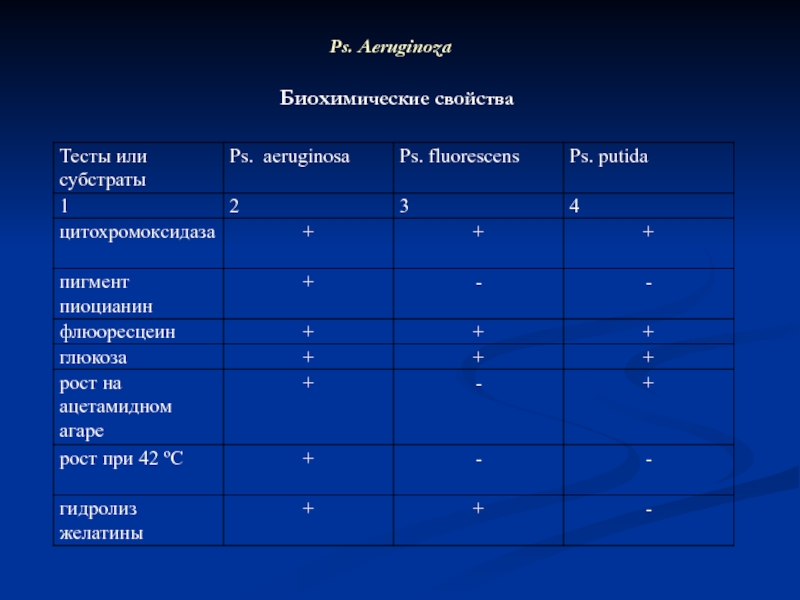
- 26. Ps. Aeruginoza Биохимические свойства
- 27. Схема быстрой идентификации Pseudomonas spp. Изоляция МПA
- 28. Микробиологические методы идентификации микробов семейства Enterobacteriaceae Морфолого-физиологические
- 29. Рост на средах На среде Эндо колонии
- 30. Выделение и идентификация грибов рода Candida Посевы
- 31. Агар Сабуро с глюкозой и хлорамфениколом
- 32. Окраска колоний грибов рода Candida и плесневых
- 33. А : Почкование дрожжей (y) На сабуро-кукурузном
Слайд 1 . Бактериологическое исследование молока и секрета вымени коров МУК №115-69 от 30.12.83г., с
Слайд 2Возбудителями острых гнойных и хронических маститов являются:
Staphylococcus aureus, α- и β-стрептококки,
м/о группы Neisseria, гемофилы, Moraxella, Nocardia.
Слайд 3Взятие материала
Материал (молоко)отбирают из пораженных долек с соблюдением правил асептики.
в конце дойки отбирать 5-10 мл альвеолярного молока.
при повторном взятии пробы с целью подтверждения диагноза на мастит могут быть использованы как цистериальное , так и альвеолярное.
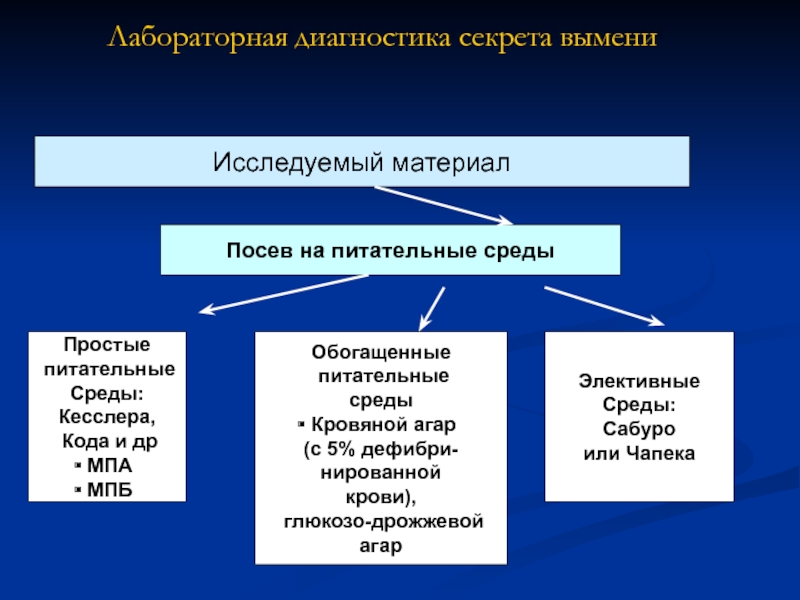
Слайд 4Лабораторная диагностика секрета вымени
Исследуемый материал
Посев на питательные среды
Простые
питательные
Среды:
Кесслера,
Кода
МПА
МПБ
Обогащенные
питательные
среды
Кровяной агар
(с 5% дефибри-
нированной
крови),
глюкозо-дрожжевой агар
Элективные
Среды:
Сабуро
или Чапека
Слайд 5Оценка результатов исследования
При появлении роста на плотных питательных средах изучают выросшие
Проводят дальнейшее изучение с целью идентификации и определения чувствительности к антибиотикам.
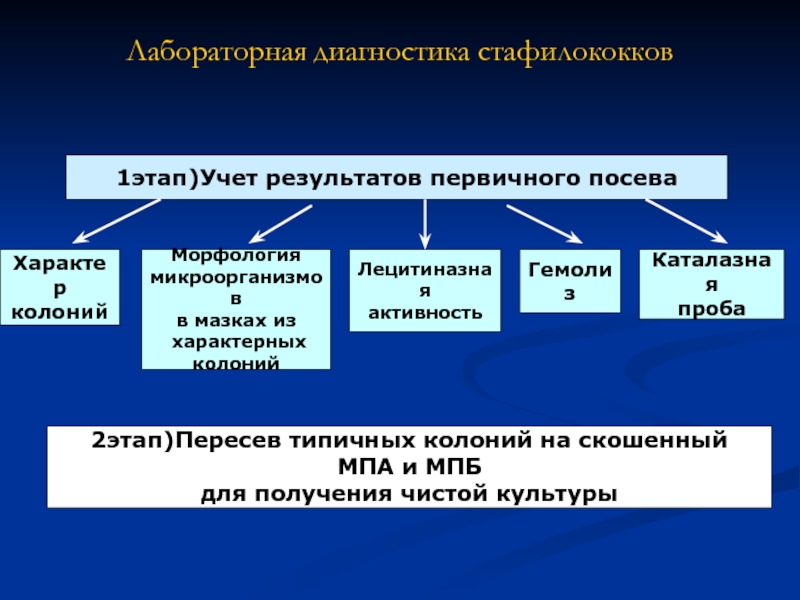
Слайд 7Лабораторная диагностика стафилококков
1этап)Учет результатов первичного посева
Характер
колоний
Морфология
микроорганизмов
в мазках из
характерных
колоний
Лецитиназная
активность
Гемолиз
Каталазная
проба
2этап)Пересев типичных колоний на скошенный
МПА и МПБ
для получения чистой культуры
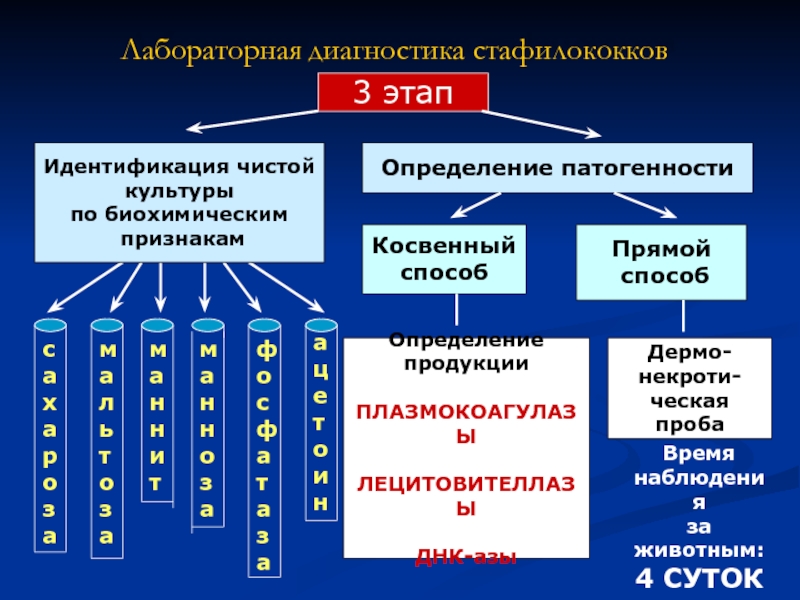
Слайд 8Определение
продукции
ПЛАЗМОКОАГУЛАЗЫ
ЛЕЦИТОВИТЕЛЛАЗЫ
ДНК-азы
Лабораторная диагностика стафилококков
3 этап
Определение патогенности
Косвенный
способ
Прямой
способ
мальтоза
маннит
сахароза
манноза
фосфатаза
ацетоин
Дермо-
некроти-
ческая
проба
Идентификация чистой
культуры
по
признакам
Время
наблюдения
за животным:
4 СУТОК
Слайд 9Морфология энтерококков. Характер роста на энтерококкагаре
Enterococcus faecalis
Enterococcus faecium
Слайд 10Лабораторная диагностика энтерококков
Подтверждение принадлежности выделенных
микроорганизмов к роду Enterococcus
Тест на каталазу
(отрицательный)
при
45ºС
в среде с
содержанием
NaCl 6,5%
в среде
с рН 9,6
в среде
С 40%
желчи
Определение возможности роста
Тест на термо-
резистентность
Подтверждение принадлежности выделенных
микроорганизмов к роду Enterococcus
Слайд 11Изучение способности
энтерококков
редуцировать
некоторые вещества
Изучение
биохимических
свойств
Редукция
метиленового
синего
(рост в молоке
с
метиленового
синего)
Редукция
тетразолия
хлорида
Устойчивость
к теллуриту
калия
Видовая идентификация энтерококков
Слайд 12Характер роста стрептококков на кровяном агаре
α-гемолитический стрептококк
β-гемолитический стрептококк
Слайд 13Микробиологические методы идентификации микробов семейства стрептококковых
Просмотр чашек с посевами
Слайд 14Лабораторная диагностика стрептококков
При наличии подозрительных в
отношении стрептококка колоний
Приготовление
мазков из
характерных
колоний и
окраска
по Граму
Тест на
каталазу
(отрицательный)
Пересев на обогащенные
питательные среды
для накопления чистой
культуры микроорганизма
МПБ
с 1% глюкозы
10% сыворотки
МПА с 5% крови
дифференциация
от Грам-
отрицательных
гемофильных
микроорганизмов
Определение
характера
роста в жидкой
питательной среде
Изучение
биохимических
свойств
Слайд 15Лабораторная диагностика
эшерихий
1-й день исследования
Исследуемый материал
Первичный посев
Ср. Кесслера, Кода и др
МПБ, Эндо,
Слайд 16Лабораторная диагностика
2-й день исследования
Учет результатов первичного посева
Морфология микроорганизмов в мазках из
Характер колоний
Пересев типичных колоний на скошенный МПА для получения чистой культуры
Слайд 17Лабораторная диагностика
3-й день исследования
Идентификация чистой культуры по биохимическим признакам
Слайд 18Пробу молока засевают в пробирки со средой Кесслера/ Кода . Посевы
Рост на среде Кесслера
Рост на среде Кода
Слайд 19Рост на средах
4 типа колоний Escherichia coli на плотных питательных средах:
сочные,
Сухие плоские R- колонии с неровными краями;
Слизистые (М) колонии;
Мелкие колонии, напоминающие колонии сальмонелл
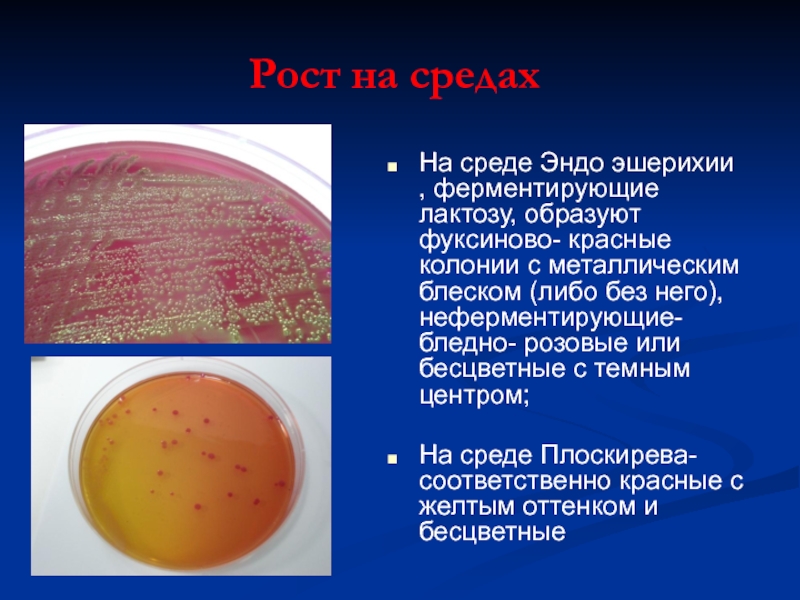
Слайд 20Рост на средах
На среде Эндо эшерихии , ферментирующие лактозу, образуют фуксиново-
На среде Плоскирева- соответственно красные с желтым оттенком и бесцветные
Слайд 21Рост на хромагенно- дифференциальных средах
На хромогенном агаре Chromocult Coliform Agar эшерихии
На хромогенной дифференциально- диагностической среде Rabach растут в виде зеленых колоний
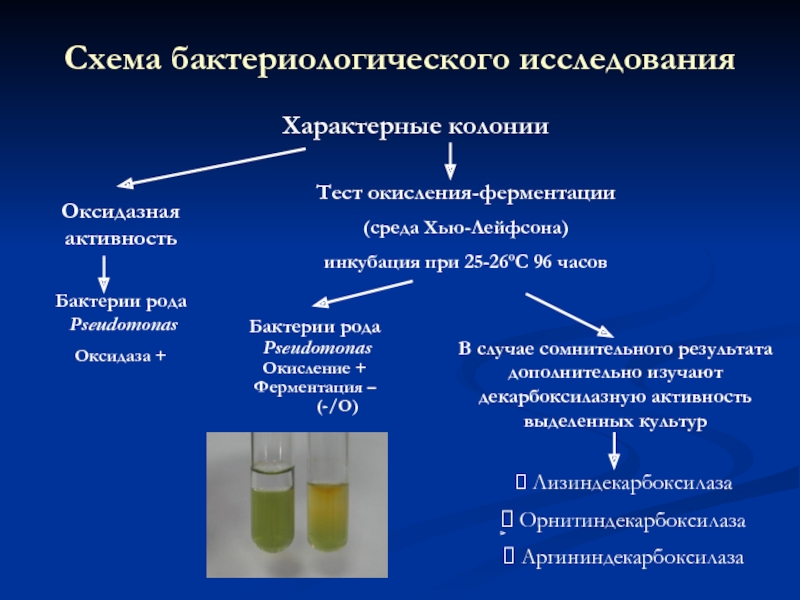
Слайд 23Схема бактериологического исследования
на синегнойную палочку
Высевы из молока на МПБ или МПА
Инкубация
Бесцветные или серовато-белые полупрозрачные, круглые выпуклые колонии с ровными краями.
На 2-4 сутки отмечают образование сине-зеленого пигмента
Среда Клиглера
инкубация 18 часов
Щелочная реакция: столбик и скошенная часть окрашиваются в малиновый цвет
контроль
Слайд 24Оксидазная активность
Бактерии рода
Pseudomonas
Оксидаза +
Тест окисления-ферментации
(среда Хью-Лейфсона)
инкубация при 25-26ºС 96 часов
В
Лизиндекарбоксилаза
Орнитиндекарбоксилаза
Аргининдекарбоксилаза
Бактерии рода
Pseudomonas
Окисление +
Ферментация –
(-/О)
Характерные колонии
Схема бактериологического исследования
Слайд 27Схема быстрой идентификации Pseudomonas spp.
Изоляция
МПA агар 37ºС 24-48часов
Круглые, непрозрачные, слизистые колонии
Исследования в отношении других патогенов
Микроскопия:
короткие палочки
грамнегативные
имеют капсулу
неподвижные
Биохимическое исследование:
Оксидаза (+)
О/Ф тест (О)
Образование зеленого пигмента (+)
Проба с хлороформом
Рост при 15-43°С(+),
На среде МППБ роста нет
Гидролиз желатина (+)
молоко
Слайд 28Микробиологические методы идентификации микробов семейства Enterobacteriaceae
Морфолого-физиологические признаки:
Грамотрицательные палочки с закругленными концами
Факультативные анаэробы, не требовательные к составу питательных сред, образующие на 1-2-е сутки при 30-37ºС характерные колонии;
Оксидазоотрицательные;
Обладающие каталазной активностью;
Обладающие нитратредуктазной активностью;
Ферментирующие и окисляющие глюкозу.
Слайд 29Рост на средах
На среде Эндо колонии представителей семейства Enterobacteriaceae обычно выпуклые
Слайд 30Выделение и идентификация грибов рода Candida
Посевы молока (секреты вымени) делают на
Слайд 31
Агар Сабуро с глюкозой и хлорамфениколом – M1067
Candida albicans (ATCC 10231
Агар с рисовым Экстрактом (M1026)
Candida albicans (ATCC 10231)
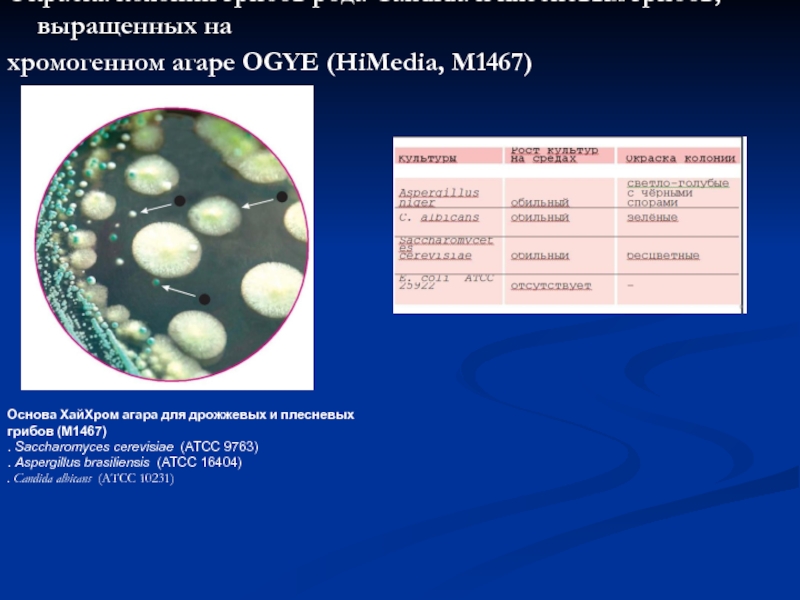
Слайд 32Окраска колоний грибов рода Candida и плесневых грибов, выращенных на
хромогенном агаре
Основа ХайХром агара для дрожжевых и плесневых грибов (M1467)
. Saccharomyces cerevisiae (ATCC 9763)
. Aspergillus brasiliensis (ATCC 16404)
. Candida albicans (ATCC 10231)
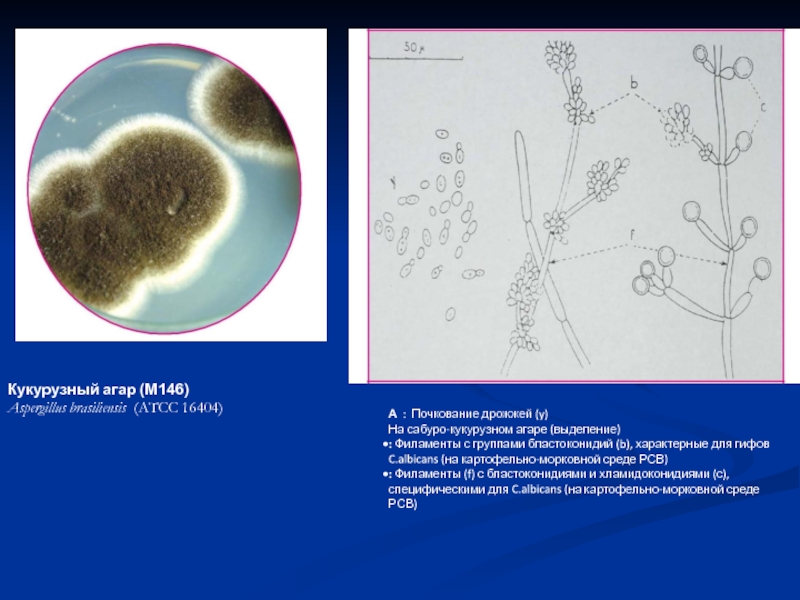
Слайд 33А : Почкование дрожжей (y)
На сабуро-кукурузном агаре (выделение)
: Филаменты с группами
: Филаменты (f) с бластоконидиями и хламидоконидиями (с), специфическими для C.albicans (на картофельно-морковной среде РСВ)
Кукурузный агар (M146)
Aspergillus brasiliensis (ATCC 16404)