- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Апоптоз. Морфологические проявления апоптоза презентация
Содержание
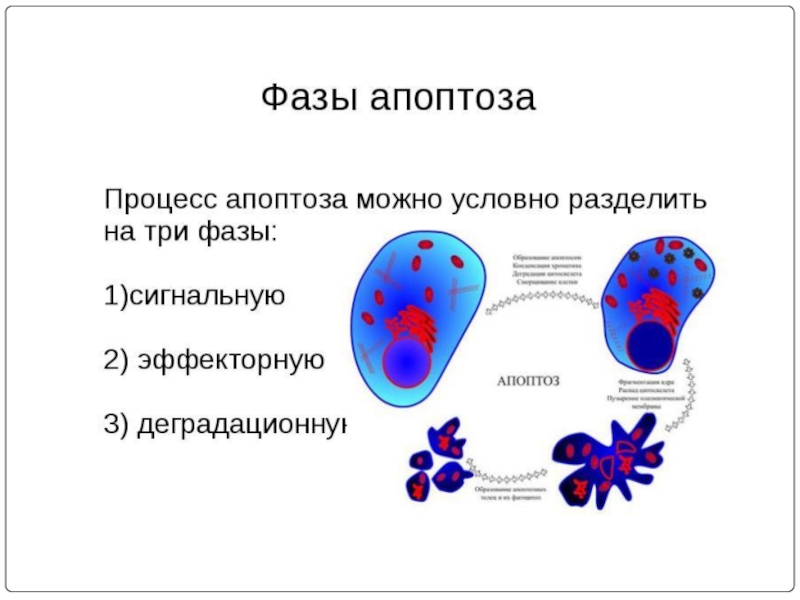
- 1. Апоптоз. Морфологические проявления апоптоза
- 2. Апоптоз — форма гибели клетки, проявляющаяся в
- 3. Исследования феномена программируемой клеточной смерти начались с
- 4. Для чего нужен апоптоз? Одной из основных
- 5. Механизм гормоны; антигены; моноклональные антитела и др.
- 8. Несмотря на разнообразие инициирующих факторов, выделяются два
- 9. Основные направления разрушительного действия каспаз на клетку:
- 10. Механизм регуляции с помощью цитокинов (путь «рецепторов
- 11. В настоящее время известно еще
- 12. Митохондриальный сигнальный путь
- 13. Раскрытие пор стимулируют следующие факторы:
- 14. Цитохром c в цитоплазме клетки участвует в формировании апоптосомы вместе
- 15. К тому же открывается доступ CARD-домена APAF-1
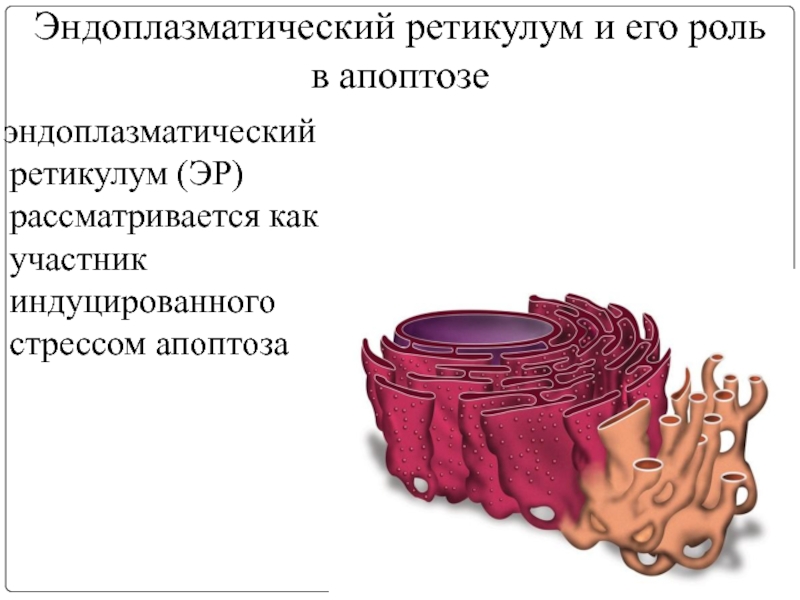
- 17. Эндоплазматический ретикулум и его роль в апоптозе
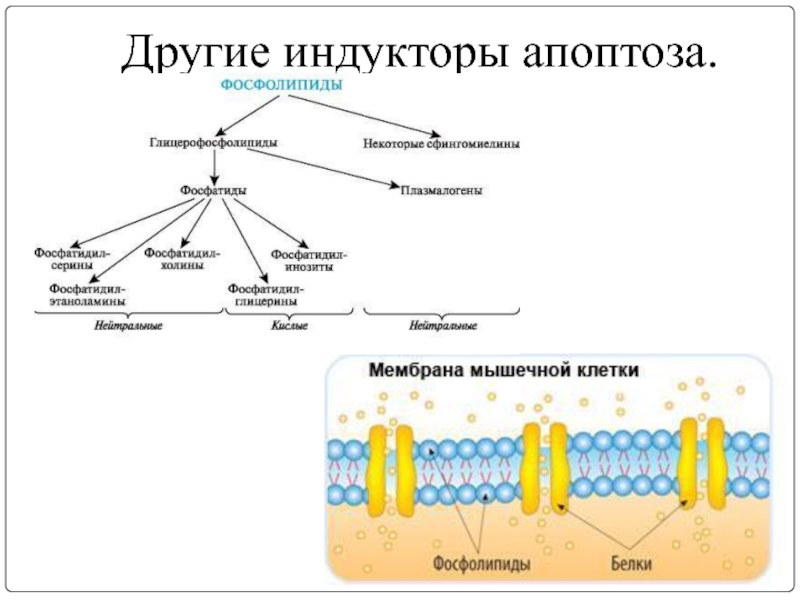
- 18. Другие индукторы апоптоза.
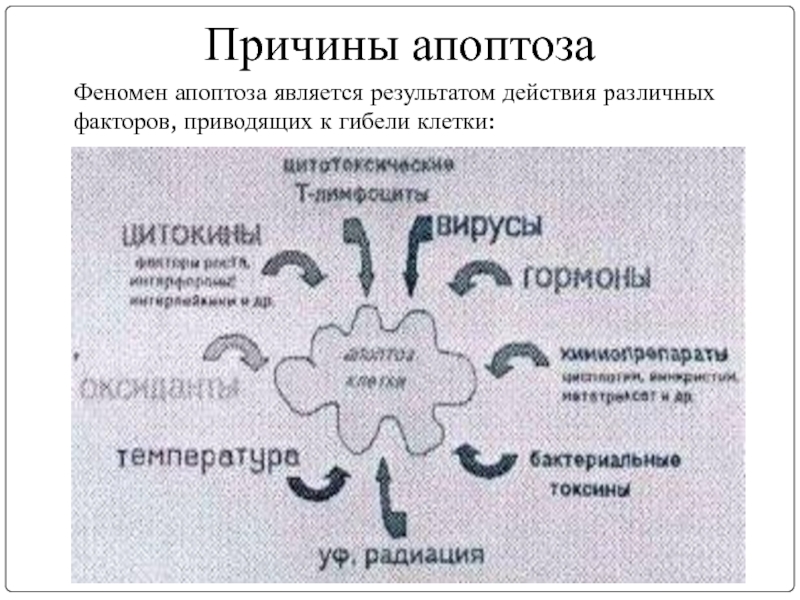
- 19. Причины апоптоза Феномен апоптоза является результатом действия различных факторов, приводящих к гибели клетки:
- 20. опухолевые заболевания аутоимунные заболевания нейродегенеративные заболевания
- 21. Заключение Апоптоз является генетически запрограммированным защитным механизмом,
- 22. Источники литературы Григорьев М. Ю. Апоптоз в
- 23. Благодарю за внимание!!!
Слайд 1Выполнил:
студент 2 курса магистратуры
Наргужина Жамила
Проверил:
к.б.н.
Тупицина Л. С.
Апоптоз
РОССИЙСКАЯ ФЕДЕРАЦИЯ
МИНИСТЕРСТВО ОБРАЗОВАНИЯ
Федеральное государственное бюджетное образовательное учреждение
высшего профессионального образования
ТЮМЕНСКИЙ ГОСУДАРСТВЕННЫЙ УНИВЕРСИТЕТ
Институт биологии
Кафедра экологии и генетики
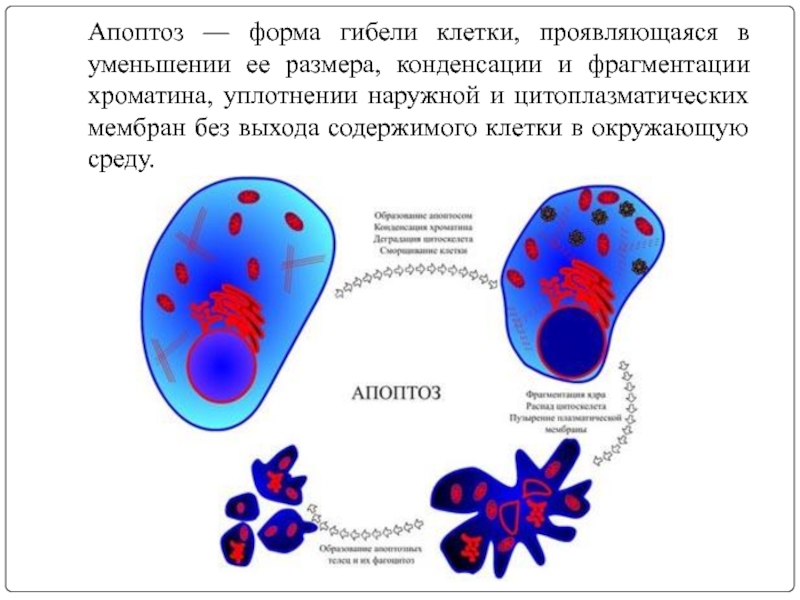
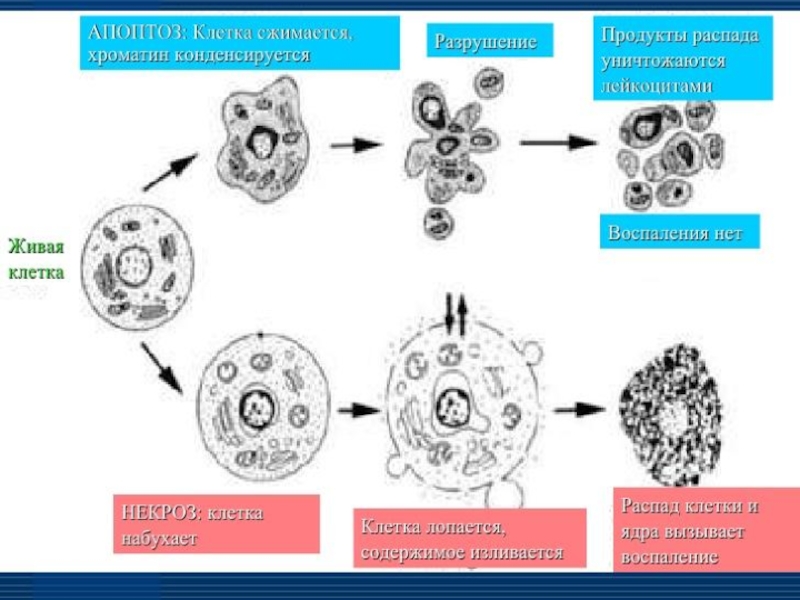
Слайд 2Апоптоз — форма гибели клетки, проявляющаяся в уменьшении ее размера, конденсации
Слайд 3Исследования феномена программируемой клеточной смерти начались с конца 1960-х годов. Одним
В 1972 году коллектив британских учёных во главе с Дж. Керром впервые предложили использовать термин «апоптоз» для обозначения программируемой клеточной смерти.
14 марта 2000 года Джон Керр был удостоен престижной премии Пауля Эрлиха и Людвига Дармштедтера за свой вклад в исследования апоптоза.
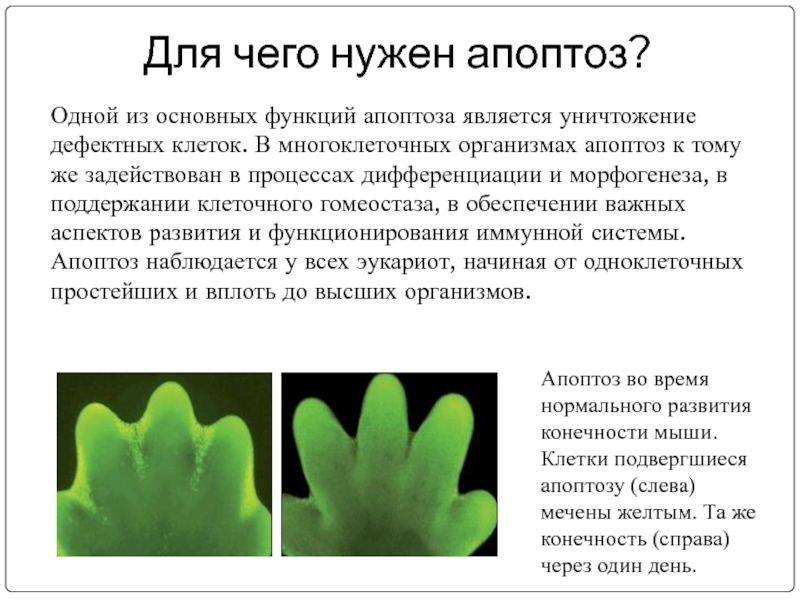
Слайд 4Для чего нужен апоптоз?
Одной из основных функций апоптоза является уничтожение дефектных
Апоптоз во время нормального развития конечности мыши. Клетки подвергшиеся апоптозу (слева) мечены желтым. Та же конечность (справа) через один день.
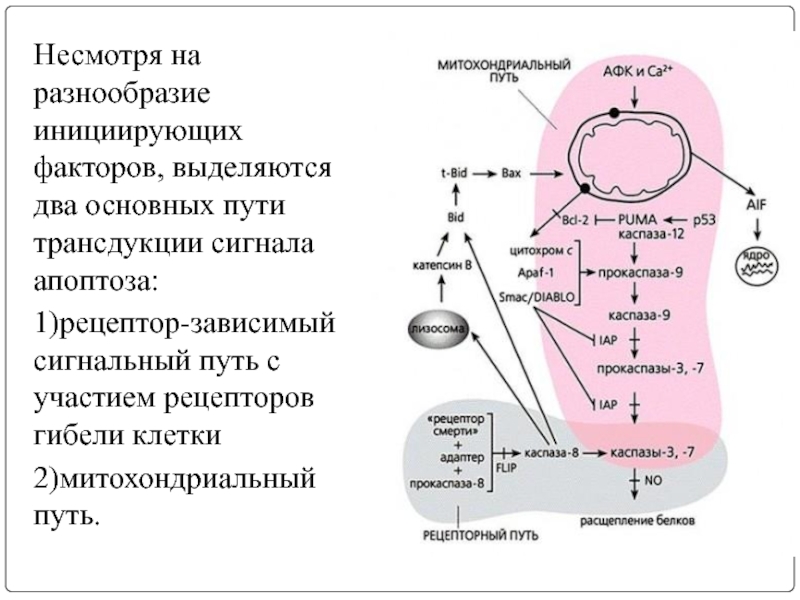
Слайд 8Несмотря на разнообразие инициирующих факторов, выделяются два основных пути трансдукции сигнала
1)рецептор-зависимый сигнальный путь с участием рецепторов гибели клетки
2)митохондриальный путь.
Слайд 9Основные направления разрушительного действия каспаз на клетку:
Инактивация ингибиторов апоптотических белков:
2. Прямое расщепление структурных белков клетки: ядерный ламин — белок, жестко связанный с ядерной мембраной и организующий структуру хроматина; активированная каспаза 6 расщепляет ламин, приводя к конденсации хроматина.
3. Нарушение регуляции белкового синтеза: гелсо- лин регулирует натяжение нитей актина; эффекторные каспазы расщепляют гелсолин, нарушая цитоскелет.
4. Инактивация белков, вовлеченных в репарацию ДНК, образование мРНК, репликацию ДНК.
Слайд 10Механизм регуляции с помощью цитокинов (путь «рецепторов смерти»)
Цитокины — группа белков,
Fas-лиганд (FasL) — цитокин семейства фактора некроза опухолей, вызывающий при взаимодействии со специфическим рецептором Fas/АРО/CD95 апоптоз клетки.
Слайд 11 В настоящее время известно еще 4 специфических рецептора к
Помимо перечисленных соединений, в клетках существует механизм негативной регуляции этого процесса — эндогенные ингибиторы К подавляющие активность К 3 и 9 и структурные гомологи проксимальных К 8 и 10. К последним относится клеточный протеин, известный как FLIP, который способен угнетать активацию К 8 и 10
Слайд 13Раскрытие пор стимулируют следующие факторы:
1)неорганический фосфат;
2)каспазы;
3)SH-реагенты;
4)истощение клеток восстановленным глутатионом
5)образование активных форм кислорода; разобщение окислительного фосфорилирования протонофорными соединениями;
6)увеличение содержания Ca в цитоплазме;
7)воздействие церамида;
8)истощение митохондриального пула АТФ .
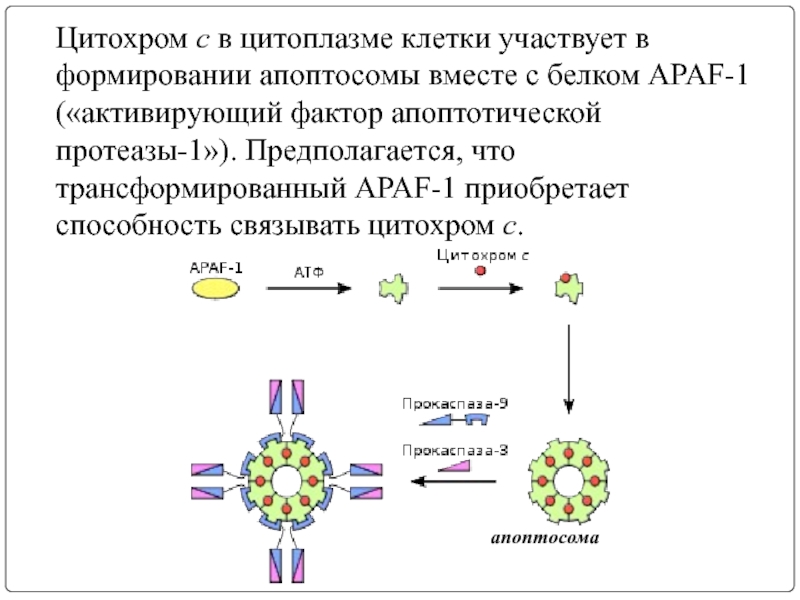
Слайд 14Цитохром c в цитоплазме клетки участвует в формировании апоптосомы вместе с белком APAF-1 («активирующий
апоптосома
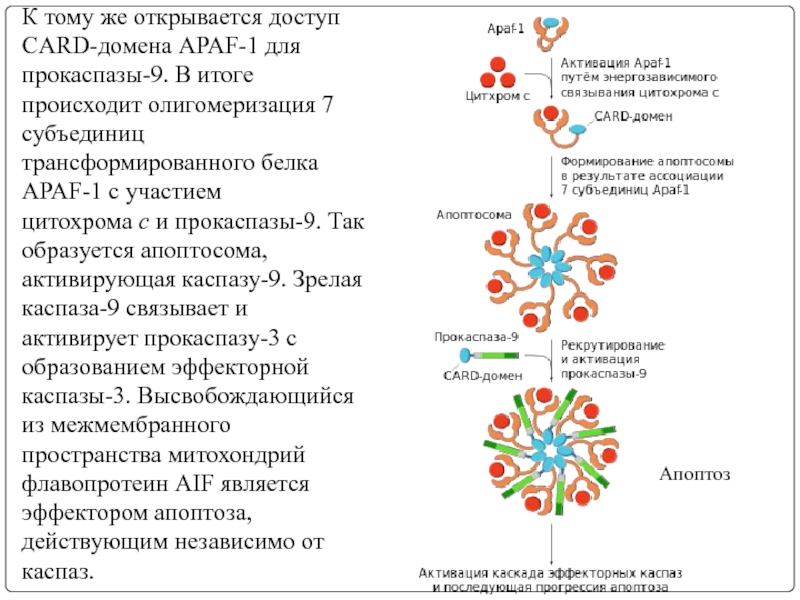
Слайд 15К тому же открывается доступ CARD-домена APAF-1 для прокаспазы-9. В итоге
Апоптоз
Слайд 17Эндоплазматический ретикулум и его роль в апоптозе
эндоплазматический ретикулум (ЭР) рассматривается
Слайд 19Причины апоптоза
Феномен апоптоза является результатом действия различных факторов, приводящих к гибели
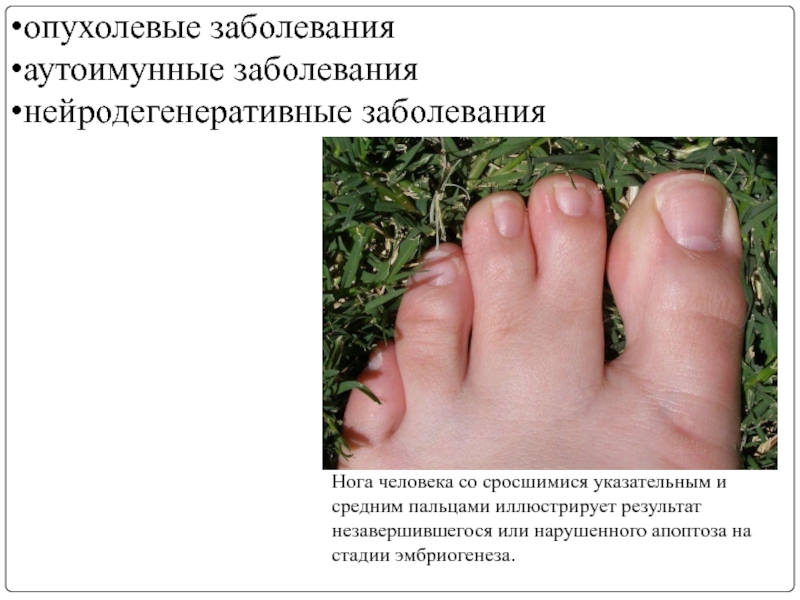
Слайд 20опухолевые заболевания
аутоимунные заболевания
нейродегенеративные заболевания
Нога человека со сросшимися указательным и средним пальцами
Слайд 21Заключение
Апоптоз является генетически запрограммированным защитным механизмом, который направлен на запуск самоуничтожения
Как правило, борьба с дефектными клетками не ограничивается только запуском апоптоза, и протекает при активации реакций клеточного и гуморального иммунитета.
Проявлением недостаточности апоптоза служит неконтролируемое деление атипичных клеток, то есть образование и рост опухоли.
В то же время, усиленный апоптоз может приводить к раннему старению, развитию клеточной аплазии и дегенерации.
В настоящее время при разработке современных методов противоопухолевого лечения немало внимания уделяется процессам клеточной регуляции и индукции апоптоза.
Слайд 22Источники литературы
Григорьев М. Ю. Апоптоз в норме и патологии / М.
Владимирская Е. Б. Механизмы апоптотической смерти клеток / Е. Б. Владимирская // Гематология и транс- фузиология. — 2002. — Т. 47, № 2. — С. 35—40.
Залесский В. Н. Перспективы патогенетически обос- нованного применения модуляторов апоптоза в качестве нейро-, кардио-, гепато- и нефропротекторов (обзор лите- ратуры) / В. Н. Залесский, А. А. Фильченков // http://www. medved.kiev.ua/arhiv_mg/st_2001/01_4_16.htm
Робинсон М. В. Апоптоз клеток иммунной системы / М. В. Робинсон, В. А. Труфакин // Успехи современной биологии. — 1991. — Т. 3, вып. 2. — С. 246—259