- Главная
- Разное
- Дизайн
- Бизнес и предпринимательство
- Аналитика
- Образование
- Развлечения
- Красота и здоровье
- Финансы
- Государство
- Путешествия
- Спорт
- Недвижимость
- Армия
- Графика
- Культурология
- Еда и кулинария
- Лингвистика
- Английский язык
- Астрономия
- Алгебра
- Биология
- География
- Детские презентации
- Информатика
- История
- Литература
- Маркетинг
- Математика
- Медицина
- Менеджмент
- Музыка
- МХК
- Немецкий язык
- ОБЖ
- Обществознание
- Окружающий мир
- Педагогика
- Русский язык
- Технология
- Физика
- Философия
- Химия
- Шаблоны, картинки для презентаций
- Экология
- Экономика
- Юриспруденция
Апоптоз. Механизмы апоптоза презентация
Содержание
- 1. Апоптоз. Механизмы апоптоза
- 2. Во время жизни животных и человека наблюдается
- 3. Механизмы апоптоза
- 4. Изменение ультраструктуры клеток при некрозе и апоптозе
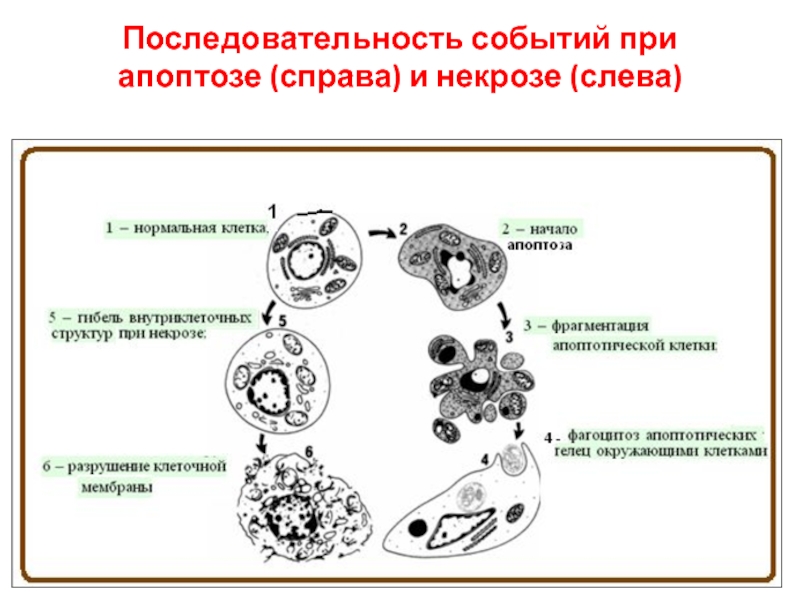
- 5. Последовательность событий при апоптозе (справа) и некрозе (слева)
- 6. Функции апоптоза
- 7. Стадии апоптоза 1. Индукция. Изменения в клеточном
- 8. Индукторы и супрессоры апоптоза Индукторы: дефицит ФР,
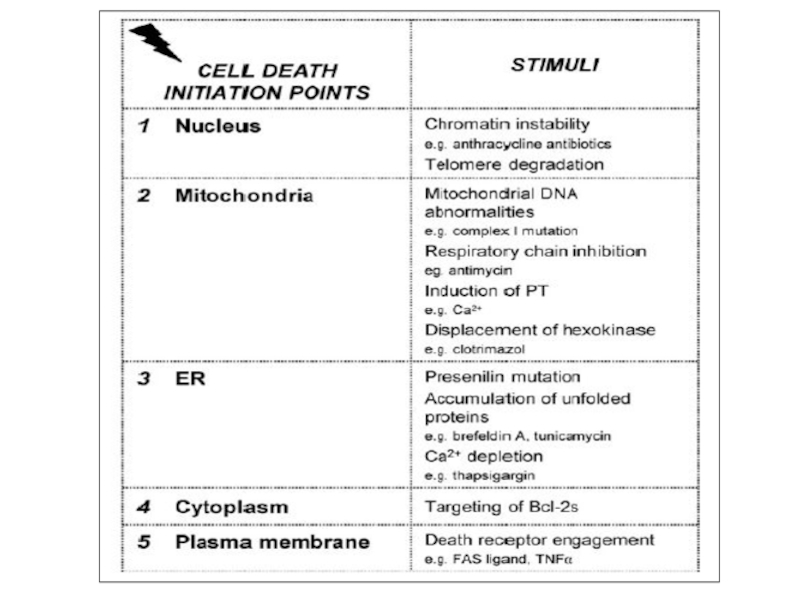
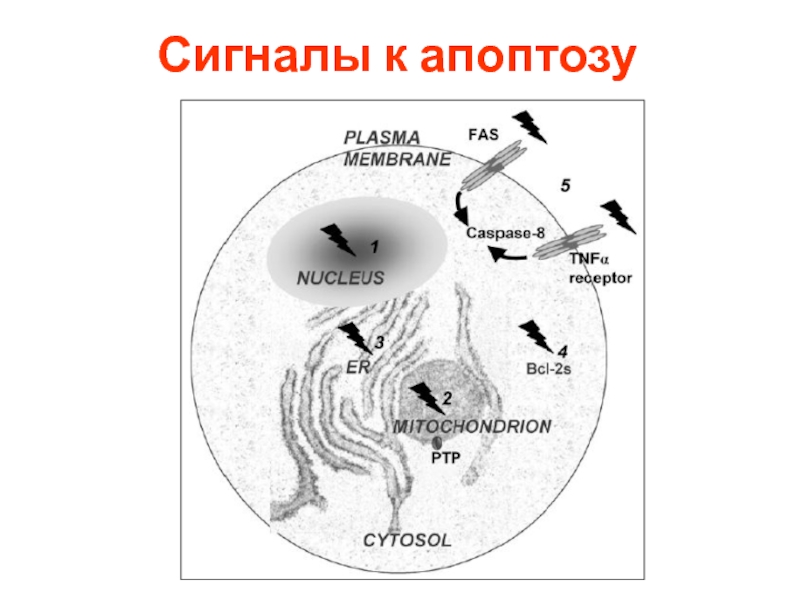
- 10. Сигналы к апоптозу
- 11. Лиганды и рецепторы Лиганды: сем. гомотримерных лигандов
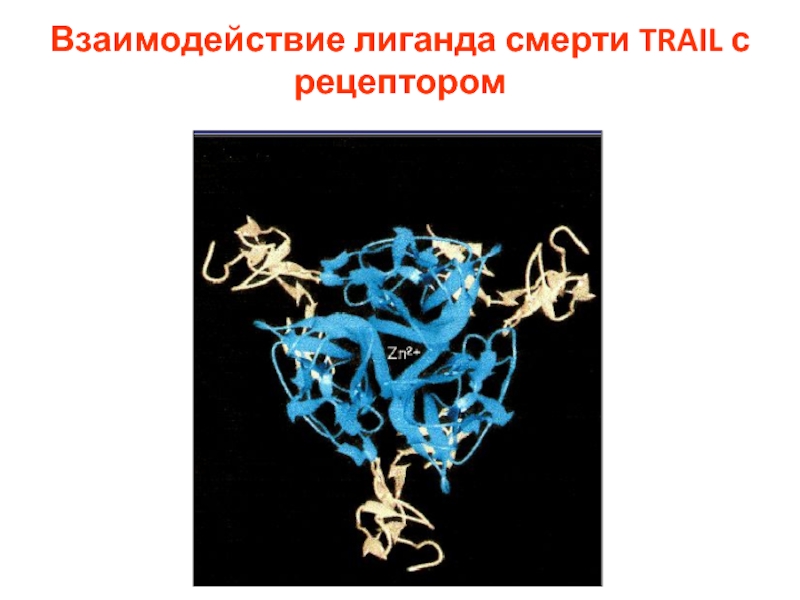
- 12. Взаимодействие лиганда смерти TRAIL с рецептором
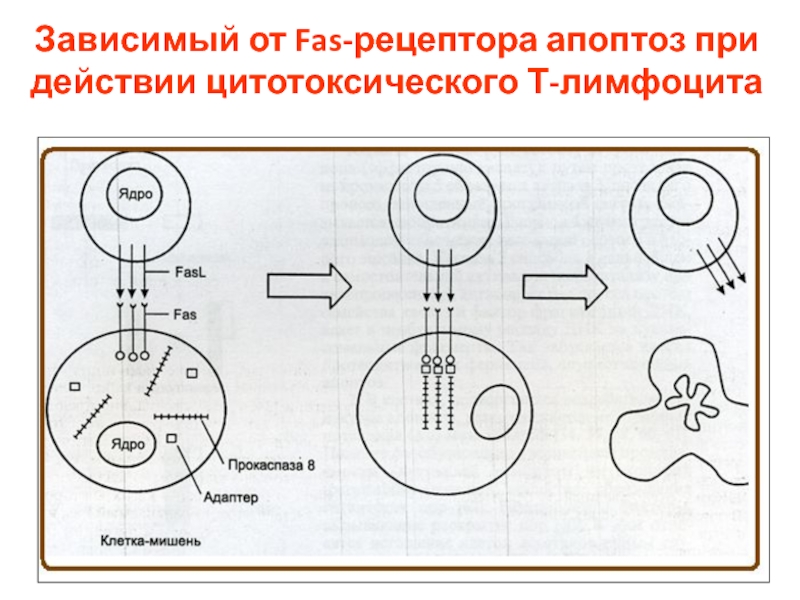
- 13. Зависимый от Fas-рецептора апоптоз при действии цитотоксического Т-лимфоцита
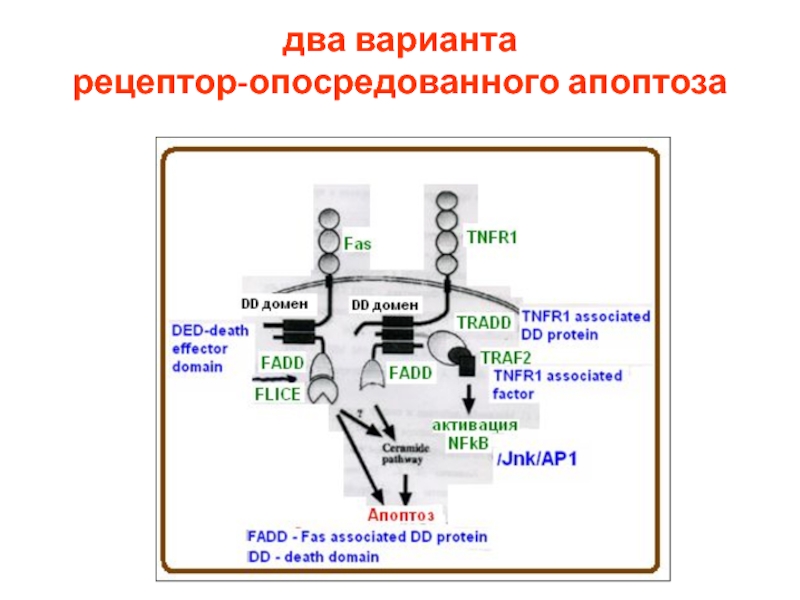
- 14. два варианта рецептор-опосредованного апоптоза
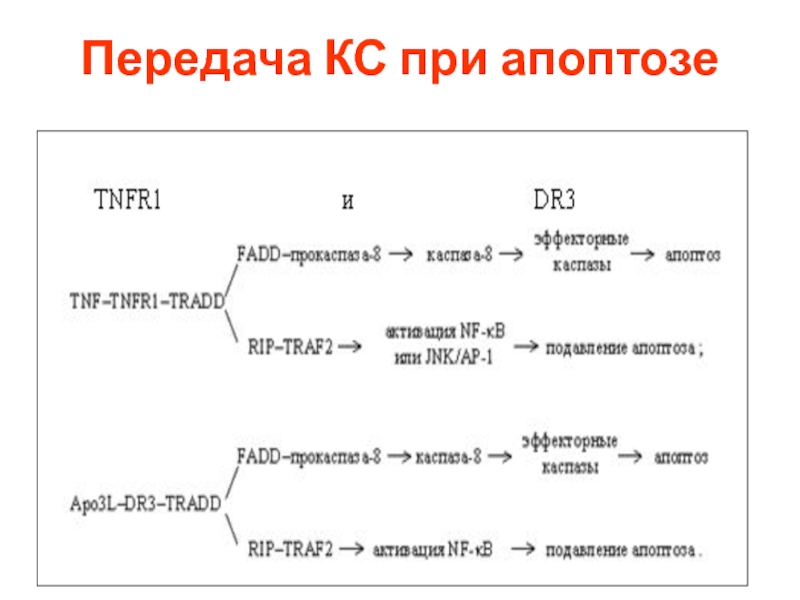
- 15. Передача КС при апоптозе
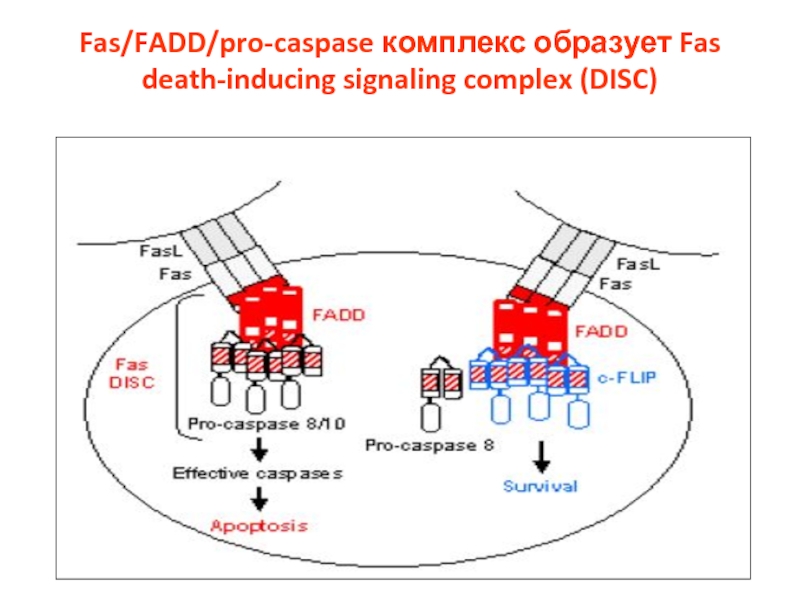
- 17. Fas/FADD/pro-caspase комплекс образует Fas death-inducing signaling complex (DISC)
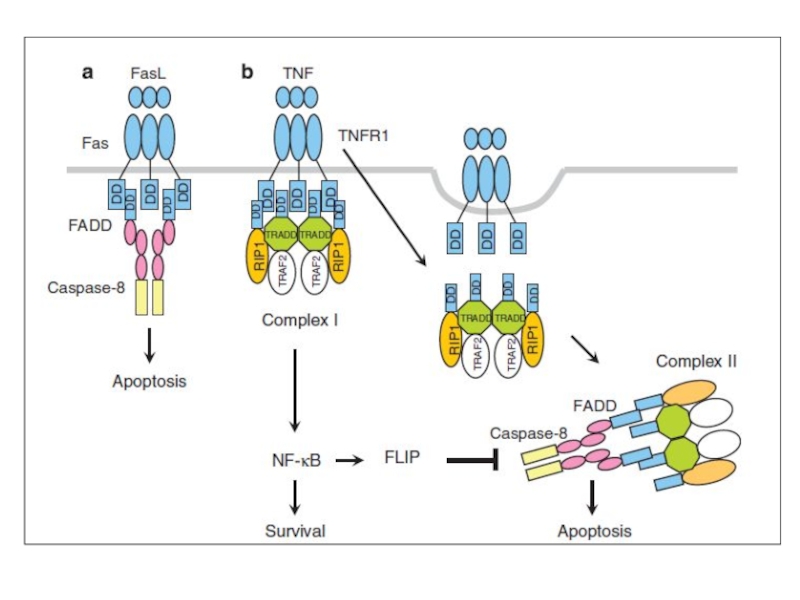
- 18. TNF-R1 инициирует образование 2-х комплексов Комплекс I
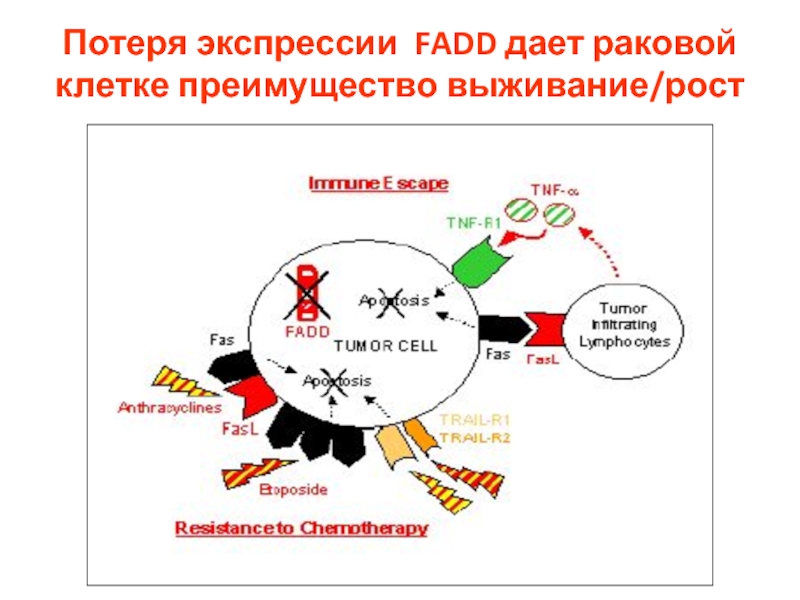
- 19. Потеря экспрессии FADD дает раковой клетке преимущество выживание/рост
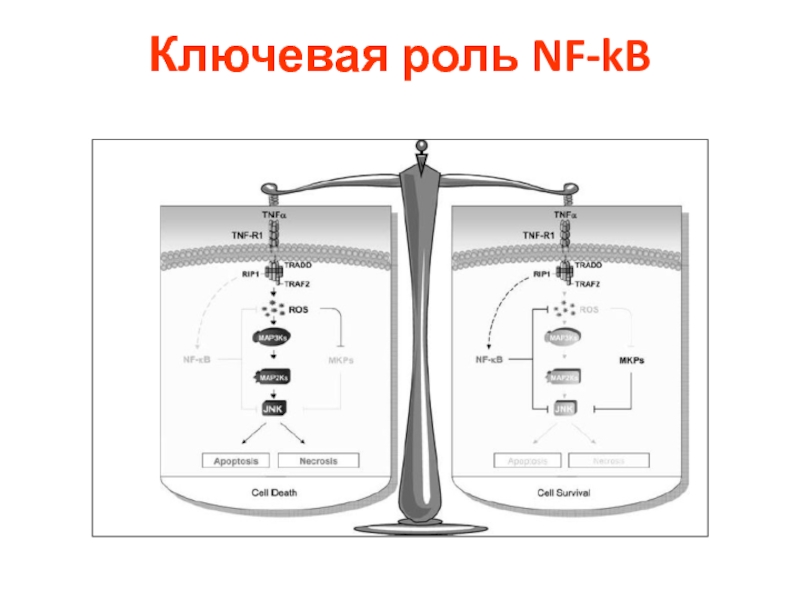
- 20. Ключевая роль NF-kB
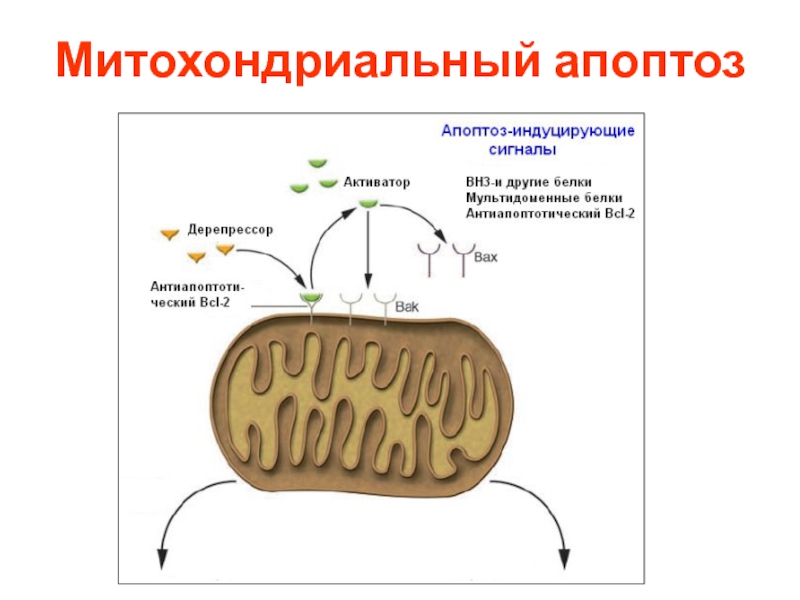
- 21. Митохондриальный апоптоз
- 23. Модель образования протеосомы
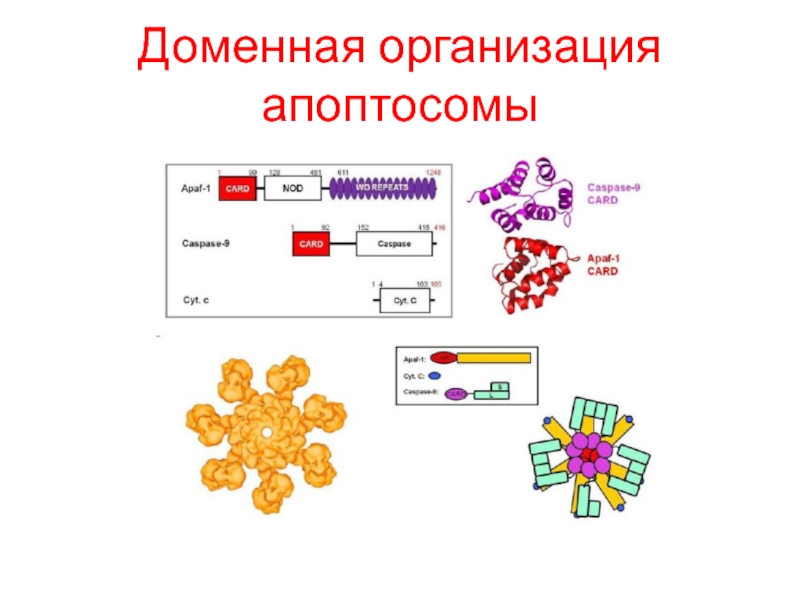
- 24. Доменная организация апоптосомы
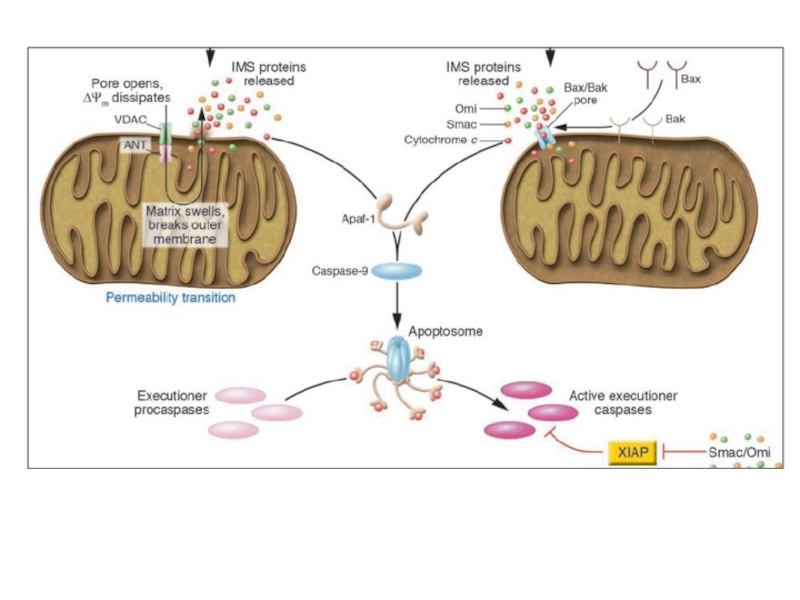
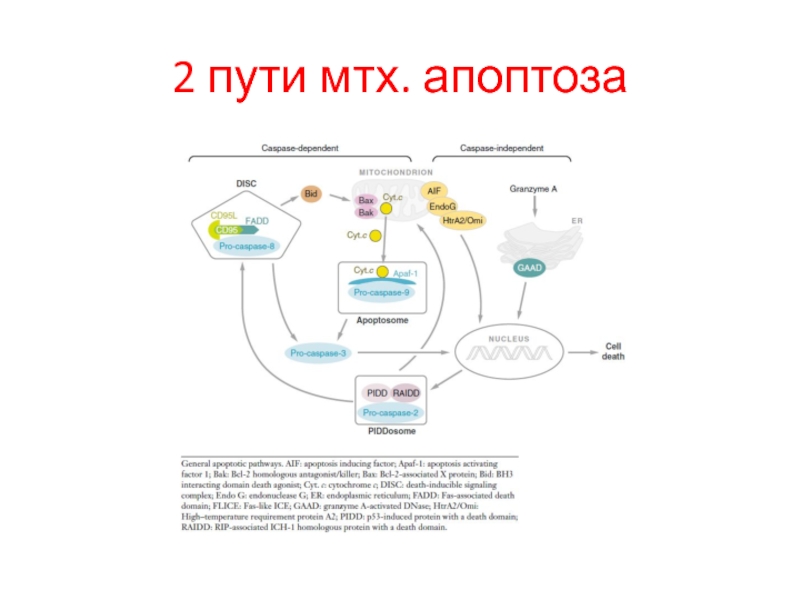
- 25. 2 пути мтх. апоптоза
- 26. Множество белков IMS (intermembrane space) высвобождается,
- 27. Механизмы MOMP
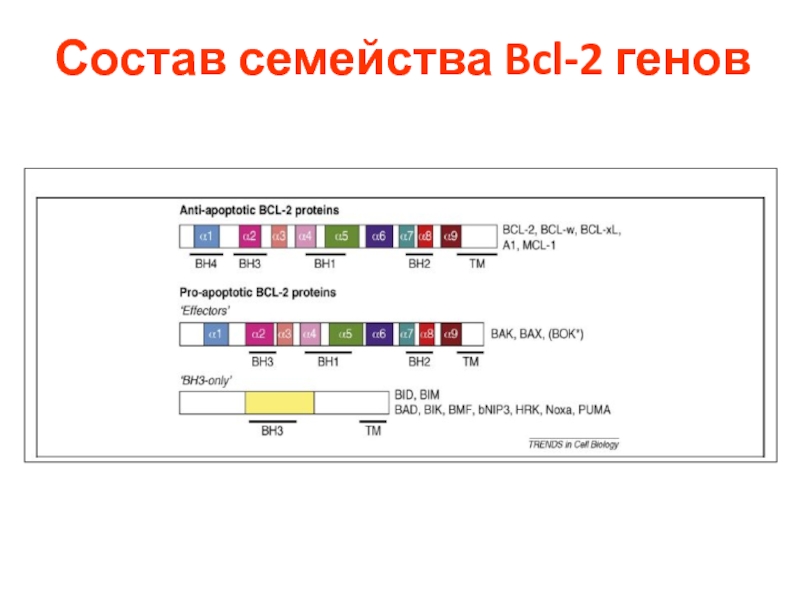
- 28. B CELL LYMPHOMA-2 (BCL-2) Семейство белков BCL-2
- 29. Состав семейства Bcl-2 генов
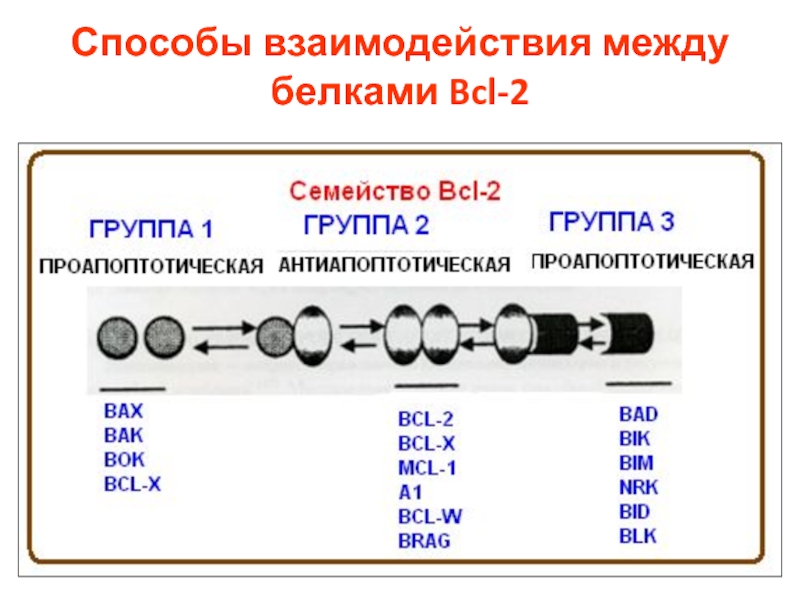
- 30. Способы взаимодействия между белками Bcl-2
- 31. Meeting points Bcl-2
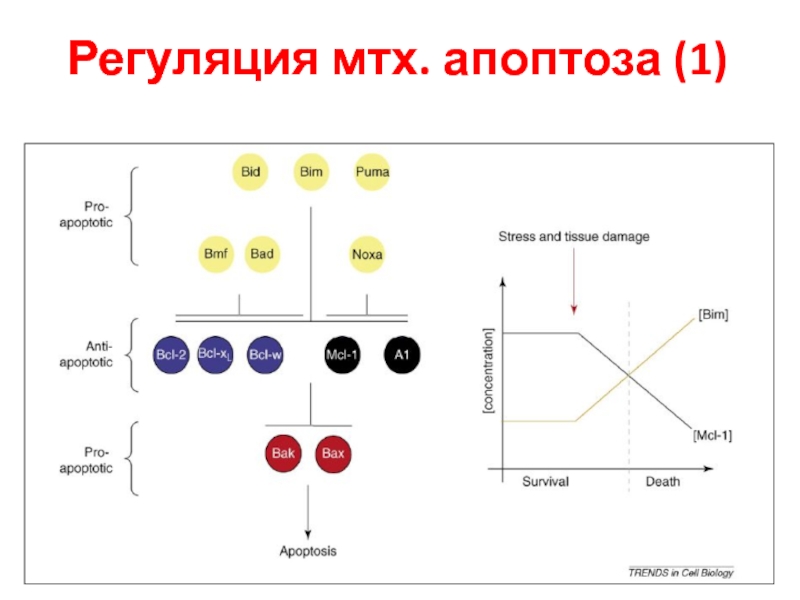
- 32. Регуляция мтх. апоптоза (1)
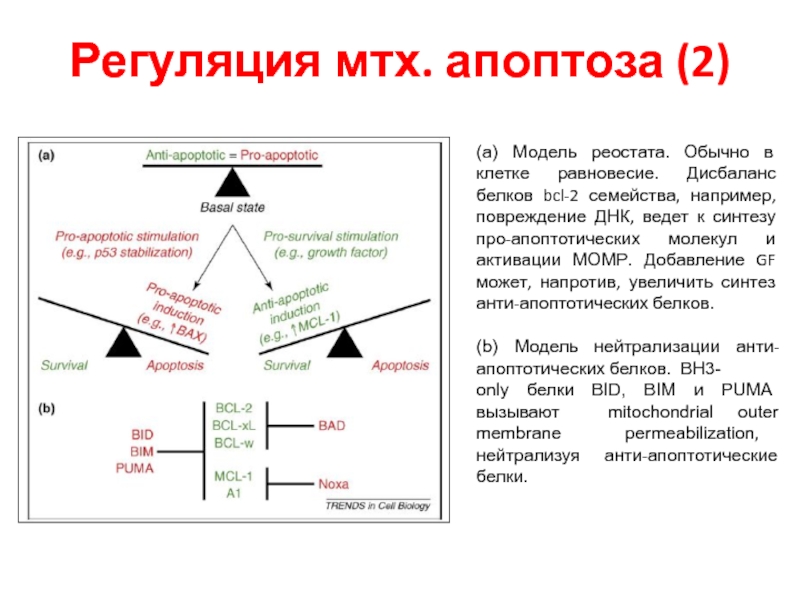
- 33. Регуляция мтх. апоптоза (2) (a) Модель реостата.
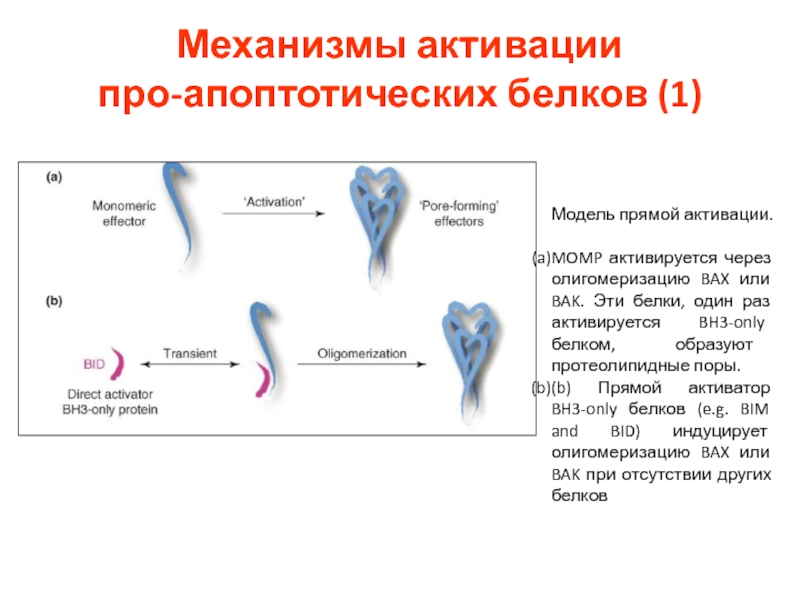
- 34. Механизмы активации про-апоптотических белков (1) Модель
- 35. Механизмы активации про-апоптотических белков (2) (c) A
- 36. СЕМЕЙСТВО ЦИСТЕИНОВЫХ ПРОТЕАЗ Каспазы
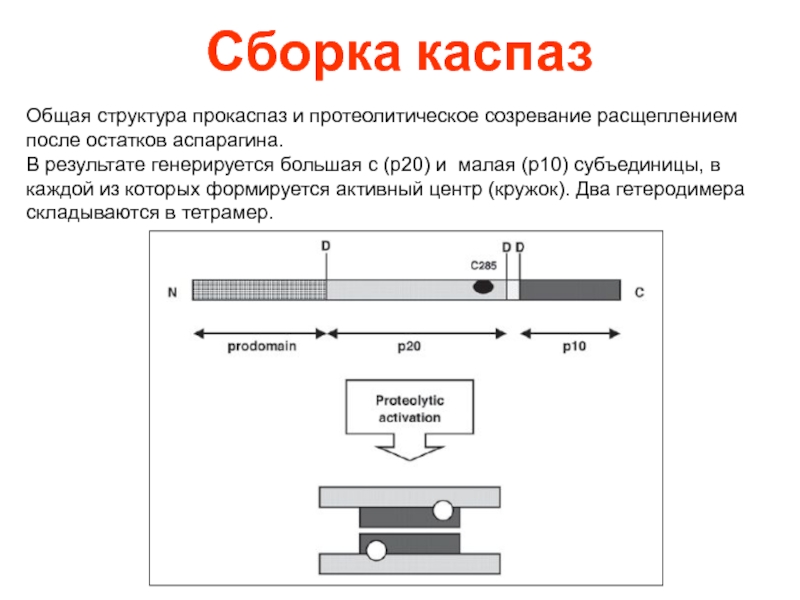
- 37. Сборка каспаз Общая структура прокаспаз и протеолитическое
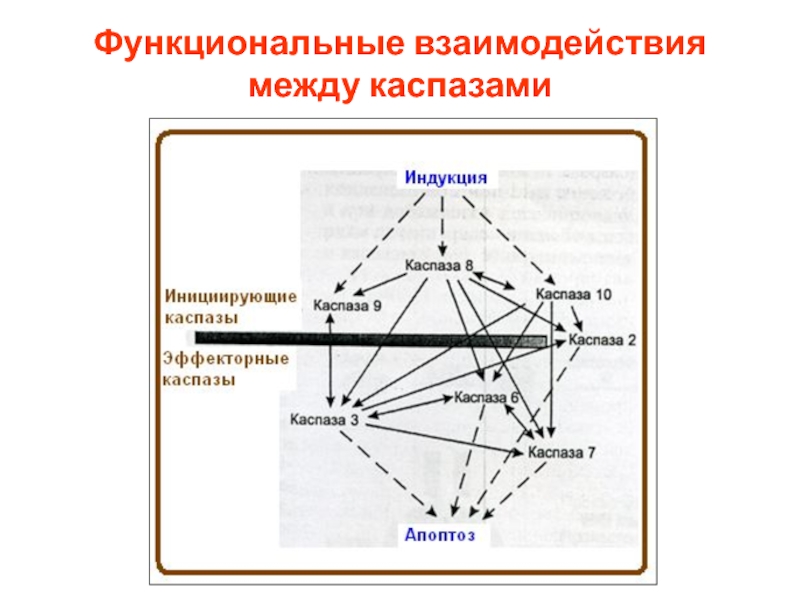
- 38. Функциональные взаимодействия между каспазами
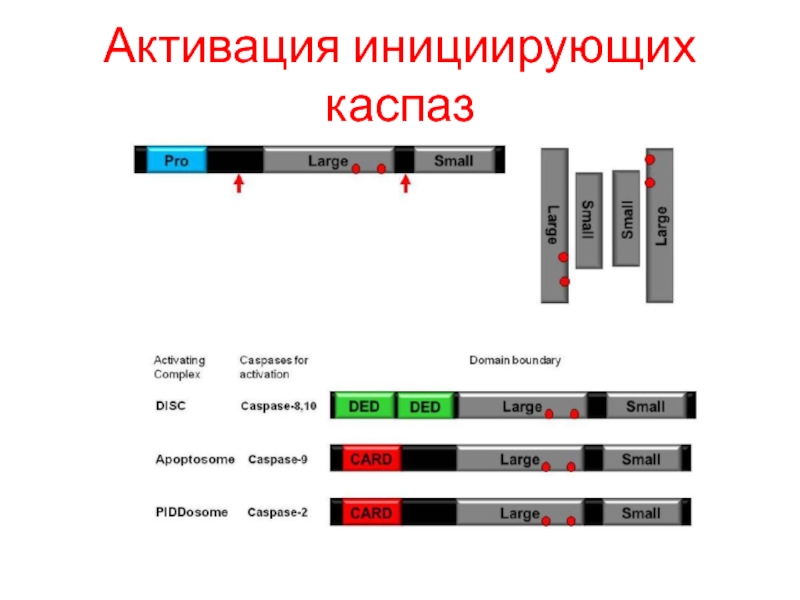
- 39. Активация инициирующих каспаз
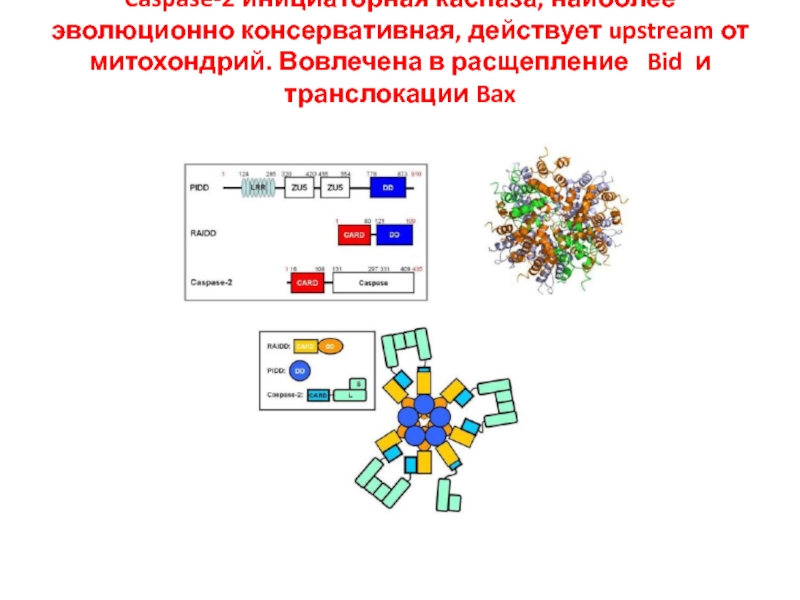
- 40. Caspase-2 инициаторная каспаза, наиболее эволюционно консервативная, действует
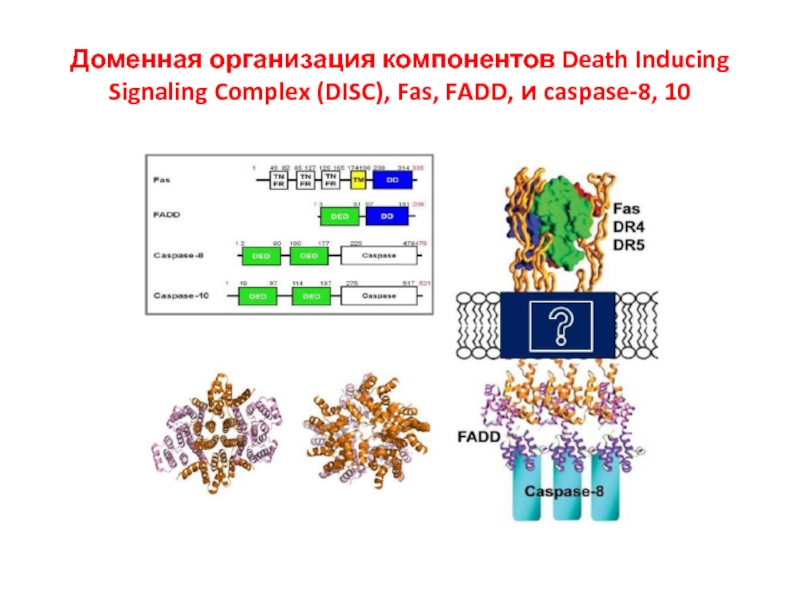
- 41. Доменная организация компонентов Death Inducing Signaling Complex (DISC), Fas, FADD, и caspase-8, 10
- 42. Структурная организация каспаз Структура и доменная организация
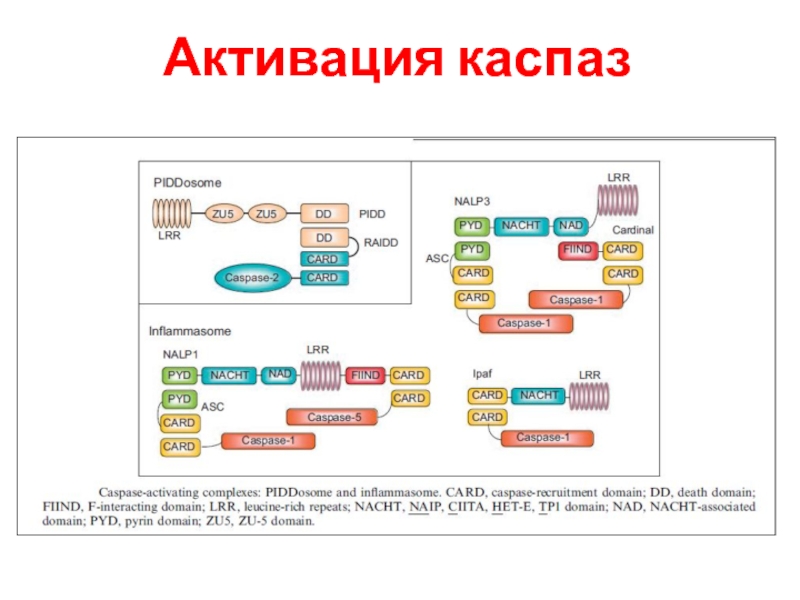
- 43. Активация каспаз
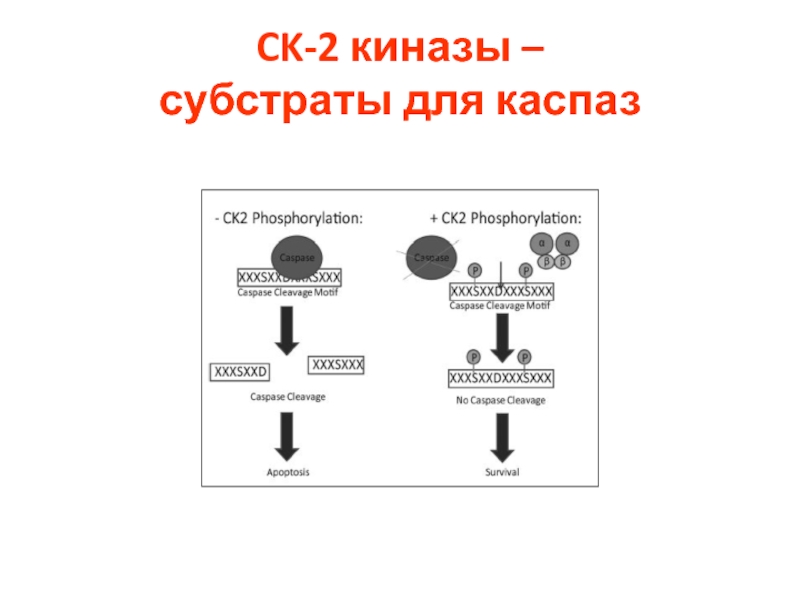
- 44. CK-2 киназы – субстраты для каспаз
- 45. CK-2 киназы в митозе Схематическое изображение CK2a
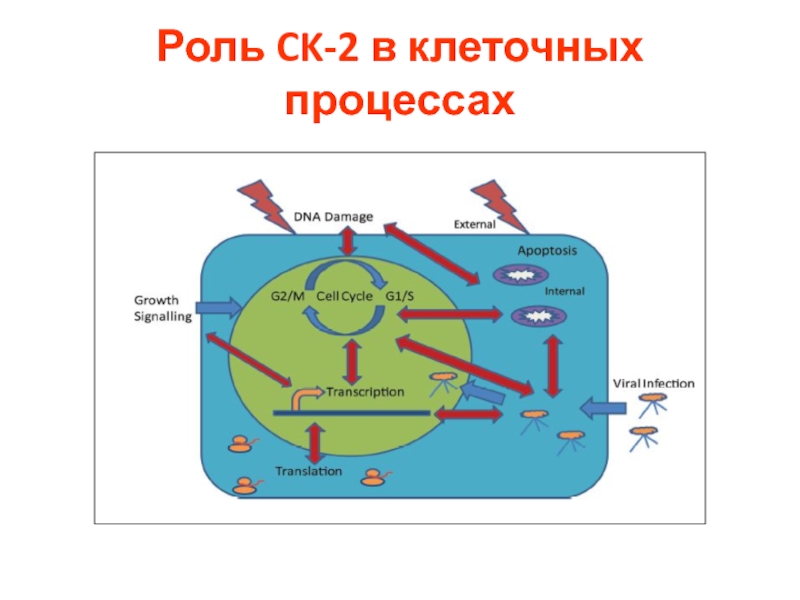
- 46. Роль CK-2 в клеточных процессах
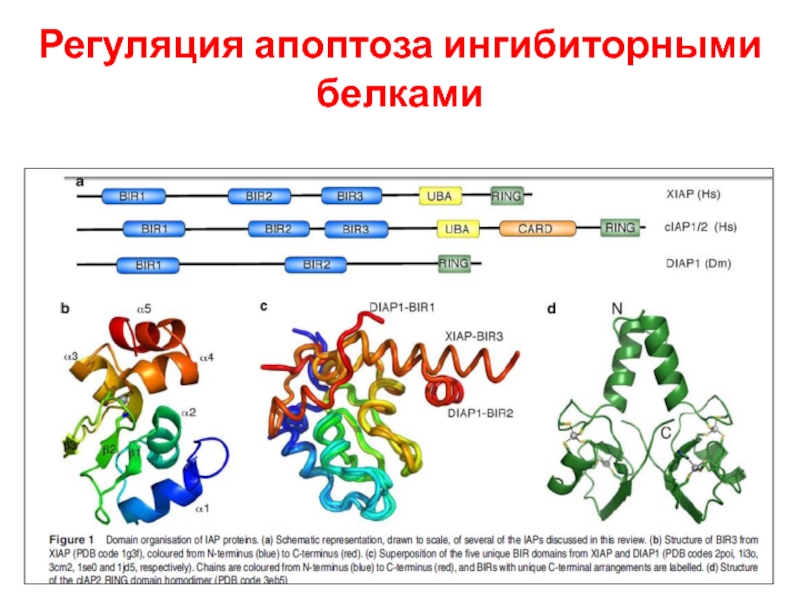
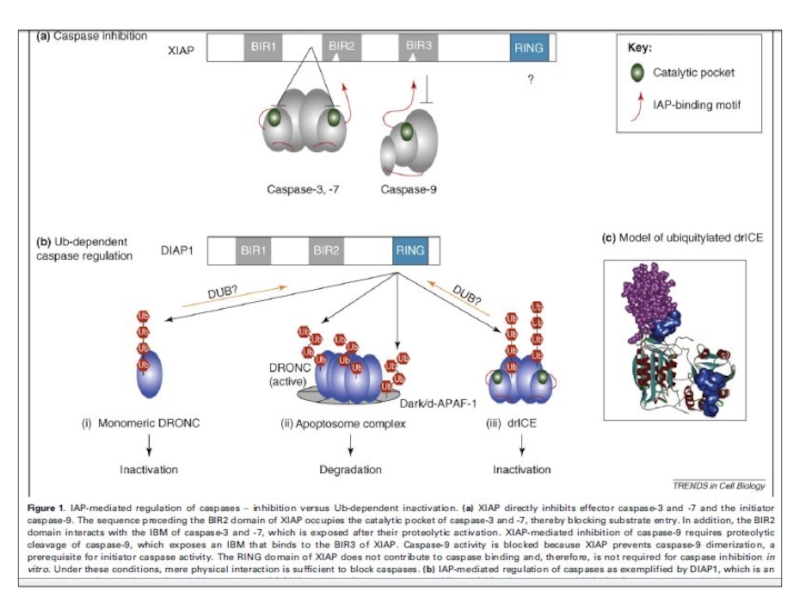
- 47. Регуляция апоптоза ингибиторными белками
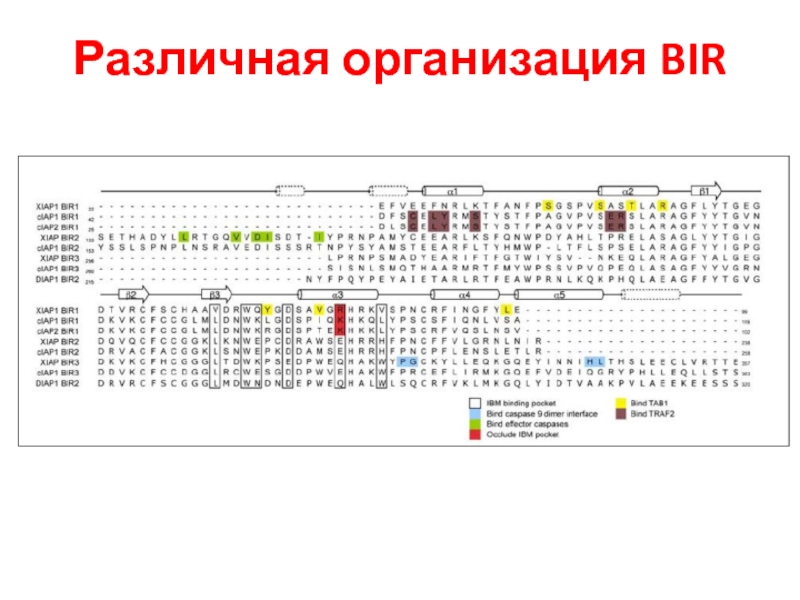
- 48. Различная организация BIR
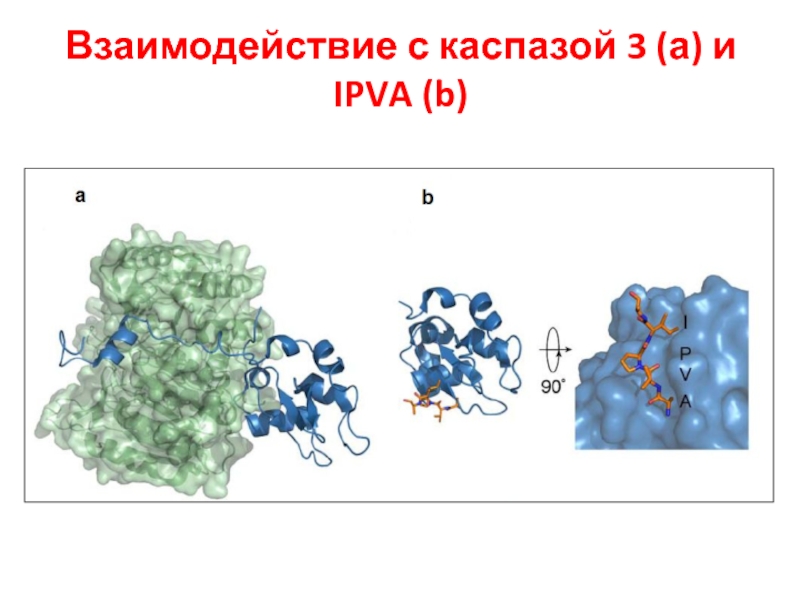
- 49. Взаимодействие с каспазой 3 (а) и IPVA (b)
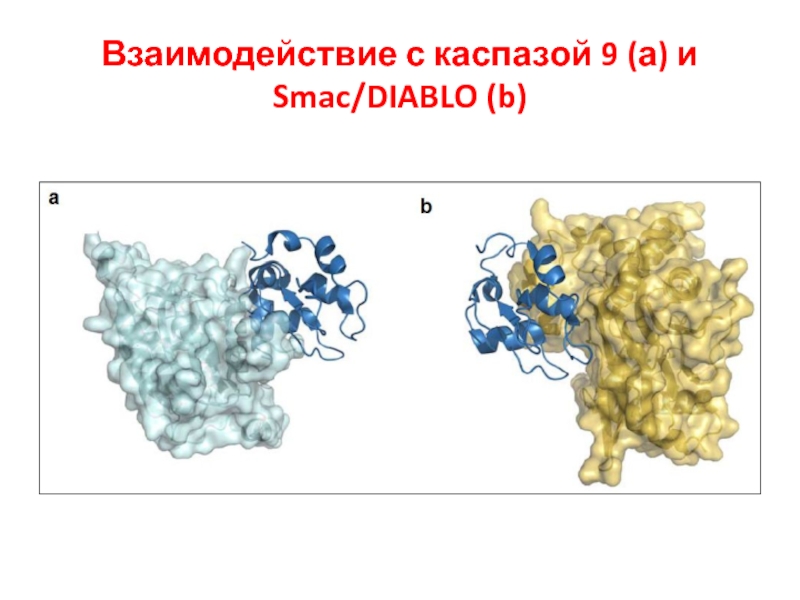
- 50. Взаимодействие с каспазой 9 (а) и Smac/DIABLO (b)
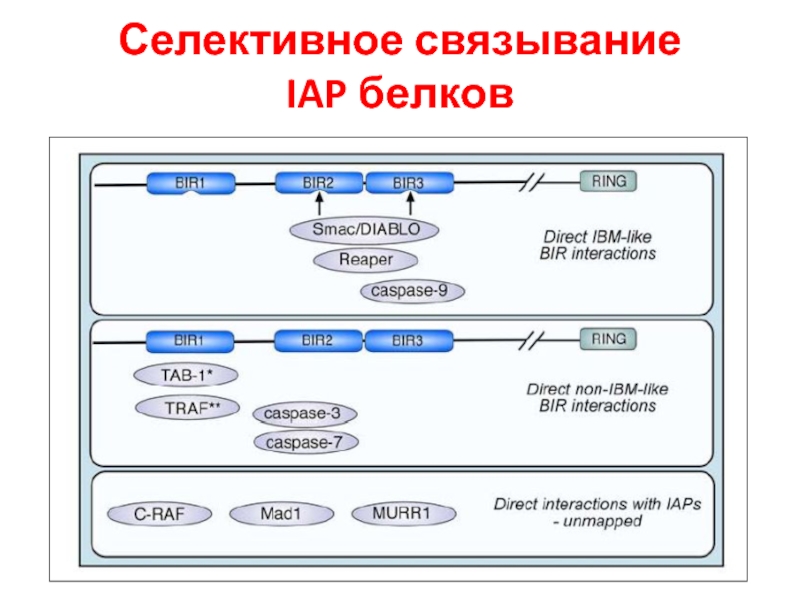
- 51. Селективное связывание IAP белков
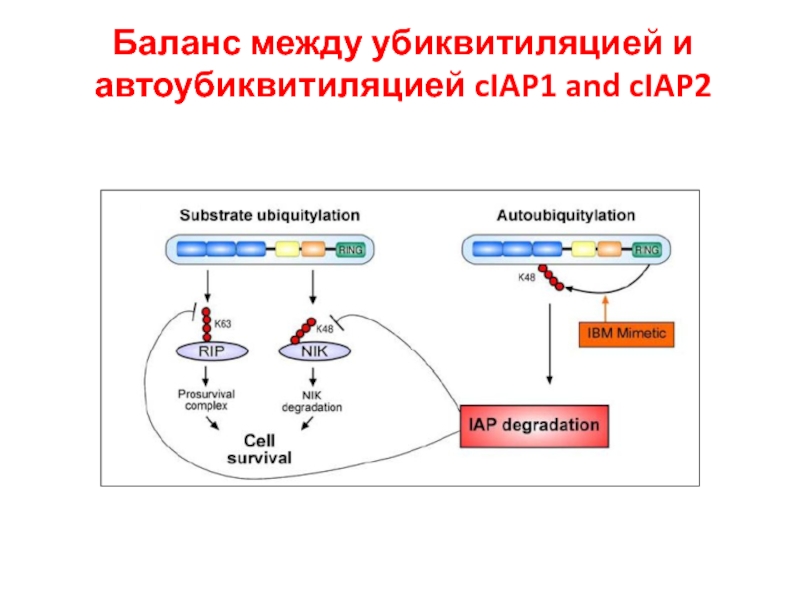
- 52. Баланс между убиквитиляцией и автоубиквитиляцией cIAP1 and cIAP2
- 53. Протеолиз и апоптоз Conjugation of Ub to
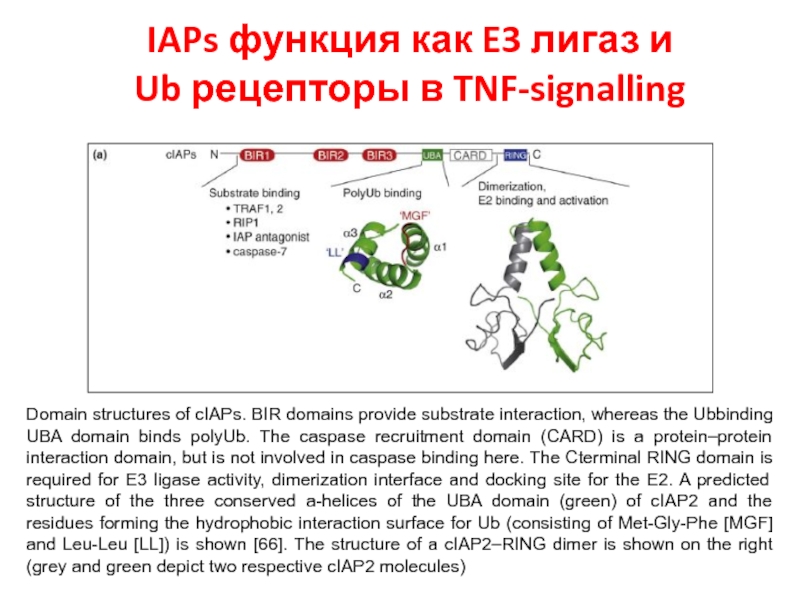
- 55. IAPs функция как E3 лигаз и
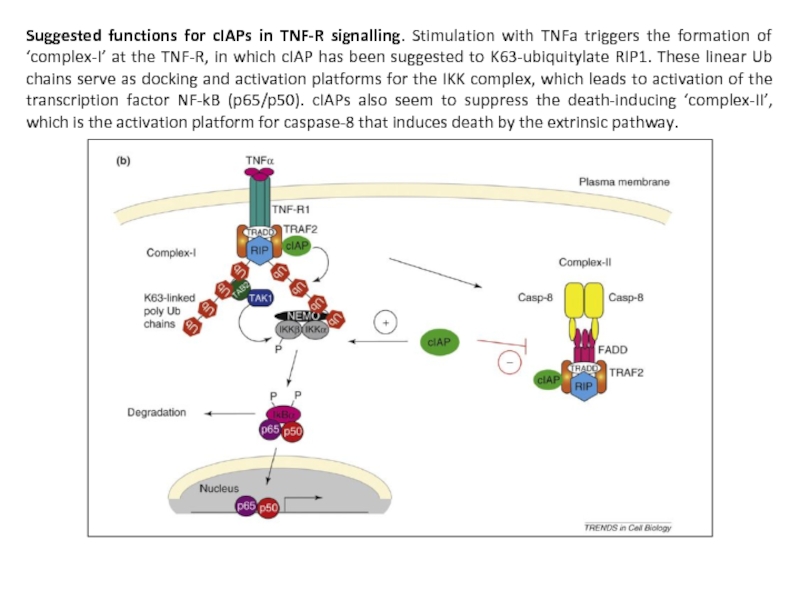
- 56. Suggested functions for cIAPs in TNF-R signalling.
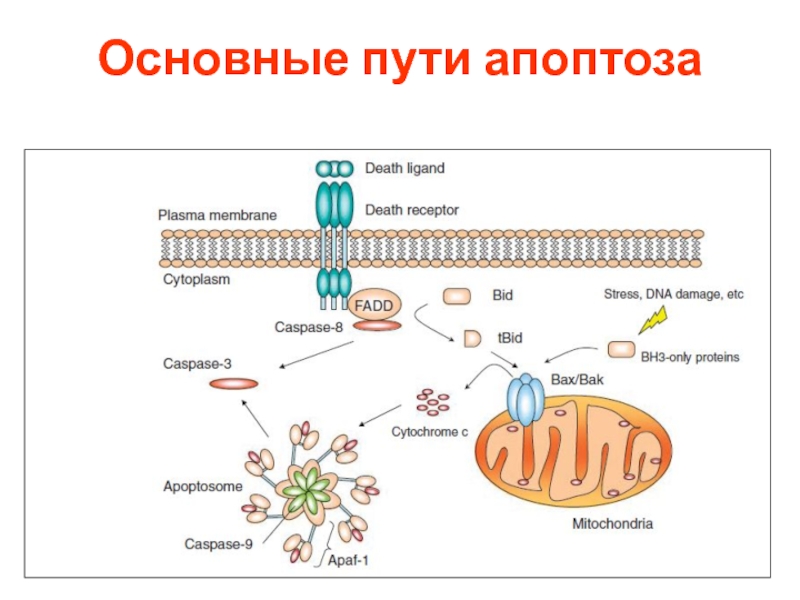
- 57. Основные пути апоптоза
- 58. Р53 – регулятор апоптоза
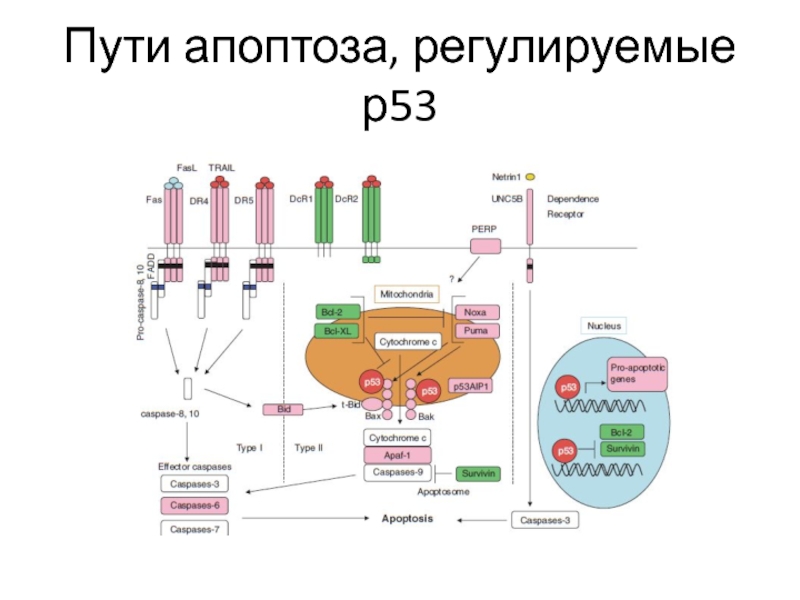
- 59. Пути апоптоза, регулируемые р53
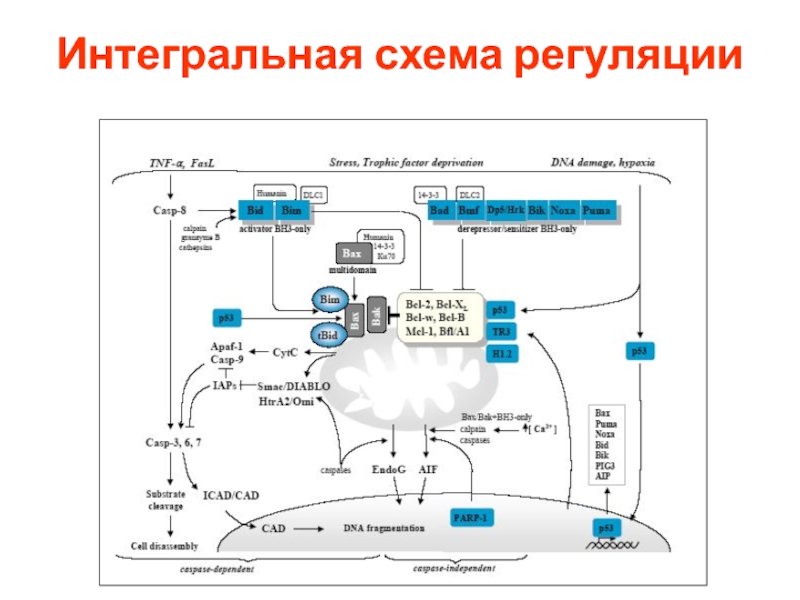
- 60. Интегральная схема регуляции
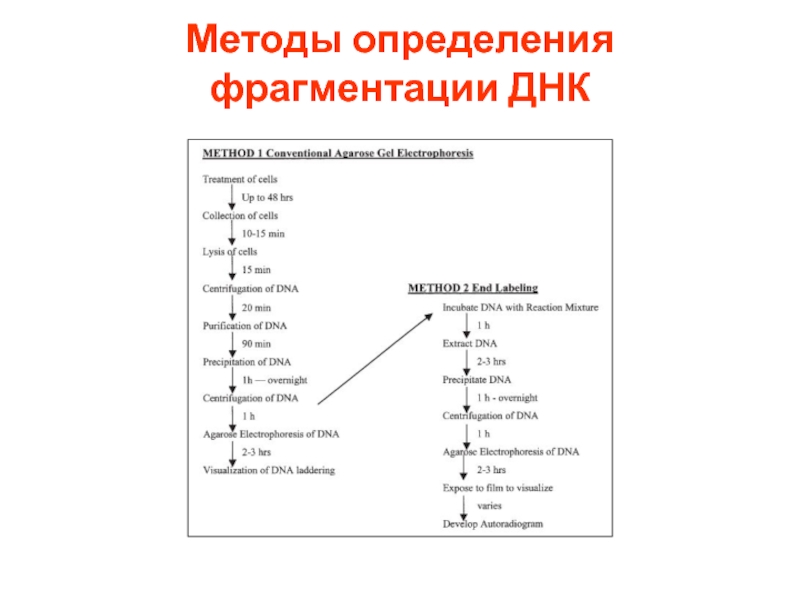
- 61. Методы определения фрагментации ДНК
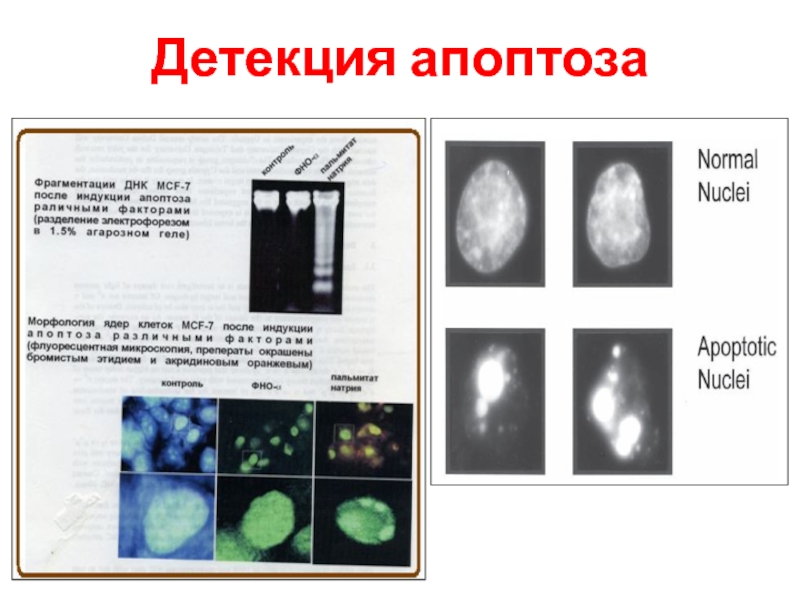
- 62. Детекция апоптоза
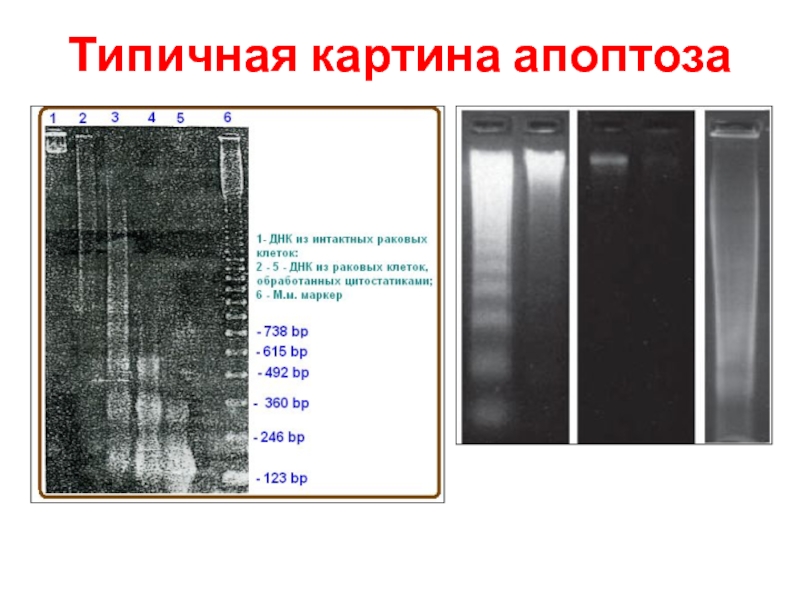
- 63. Электрофореграмма ДНК при апоптозе
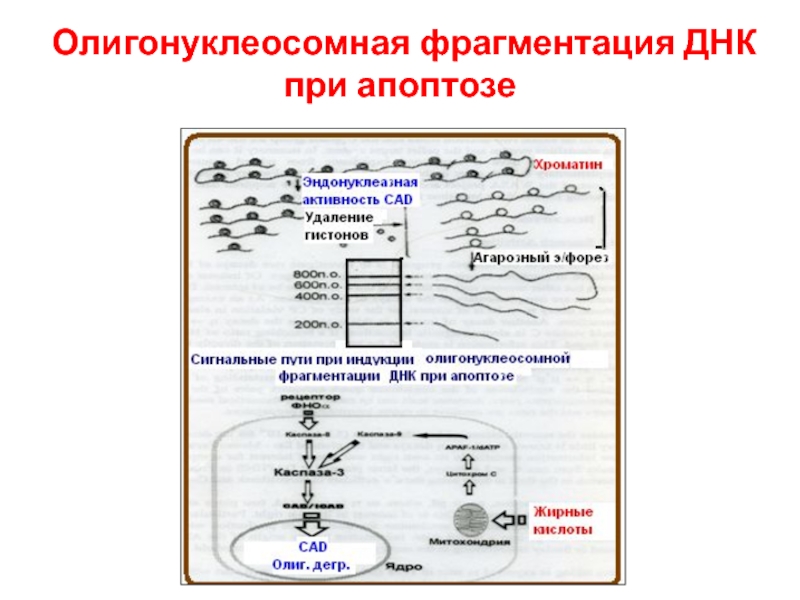
- 64. Олигонуклеосомная фрагментация ДНК при апоптозе
- 65. Типичная картина апоптоза
- 66. Молекулярный имидж клеточной гибели (c 2009 г.)
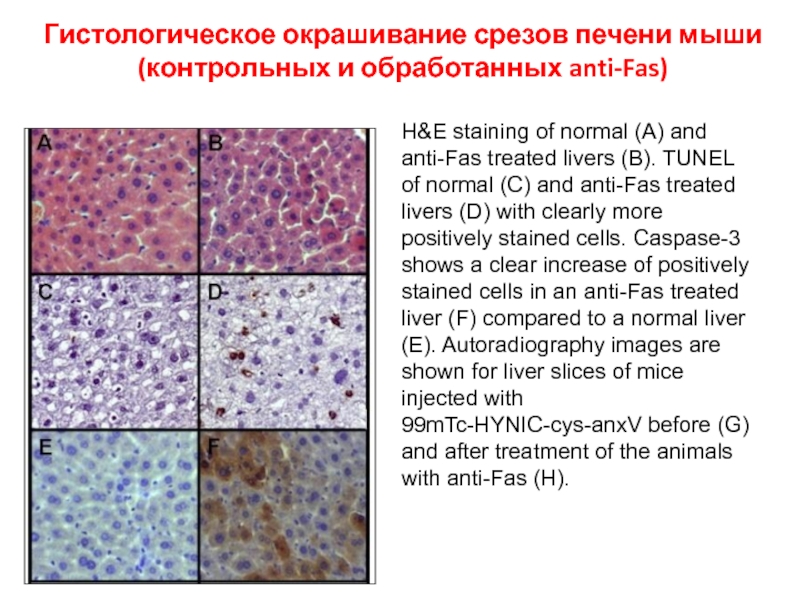
- 67. Гистологическое окрашивание срезов печени мыши (контрольных и
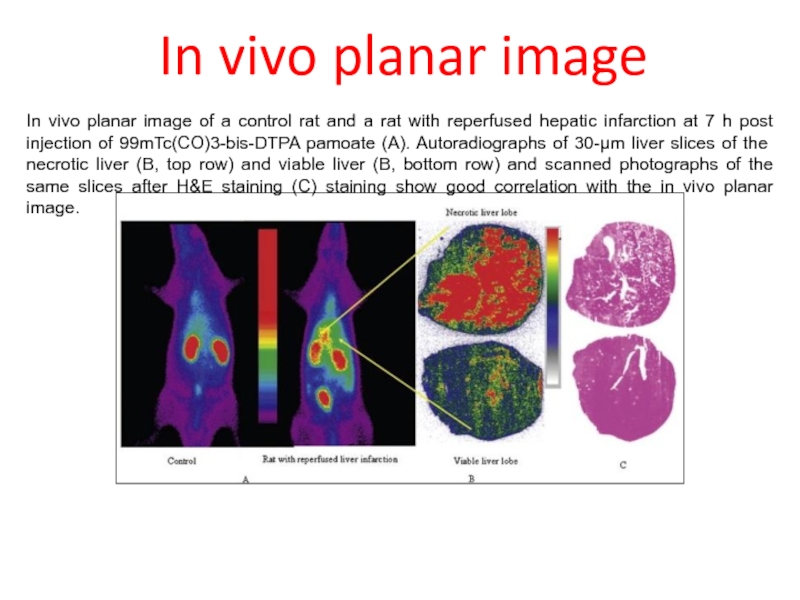
- 68. In vivo planar image In vivo
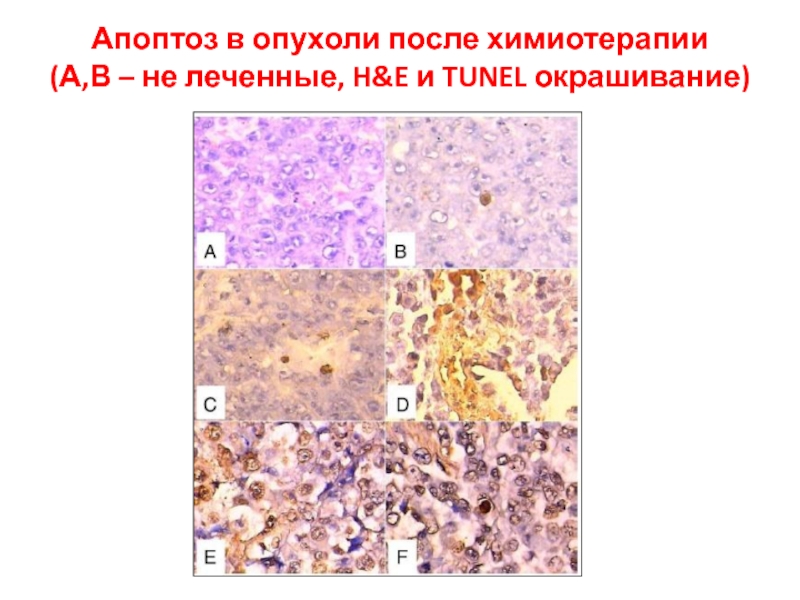
- 69. Апоптоз в опухоли после химиотерапии (А,В – не леченные, H&E и TUNEL окрашивание)
- 70. Определение активности каспаз
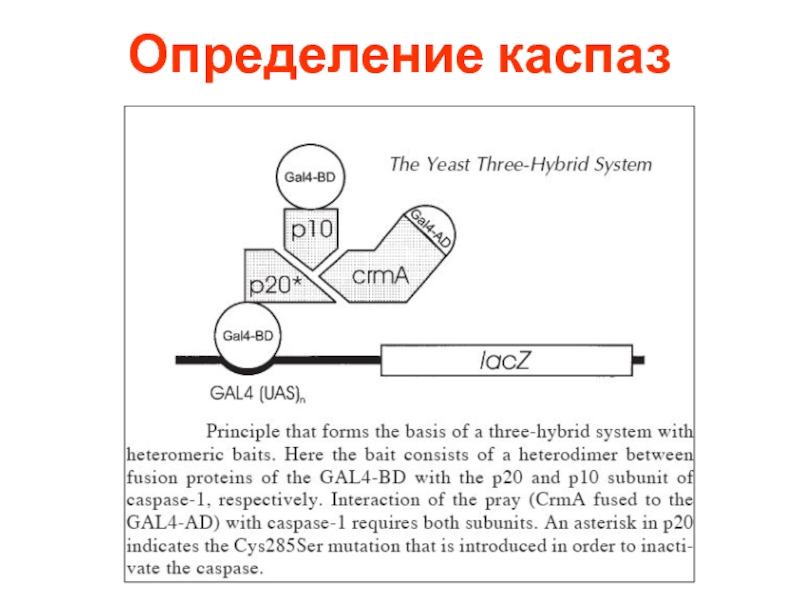
- 71. Определение каспаз
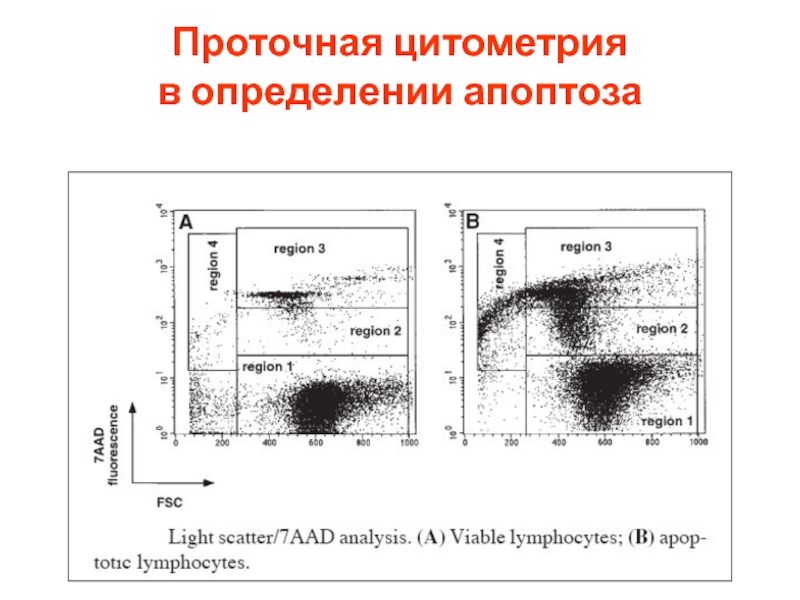
- 72. Проточная цитометрия в определении апоптоза
- 73. Определение мит. апоптоза
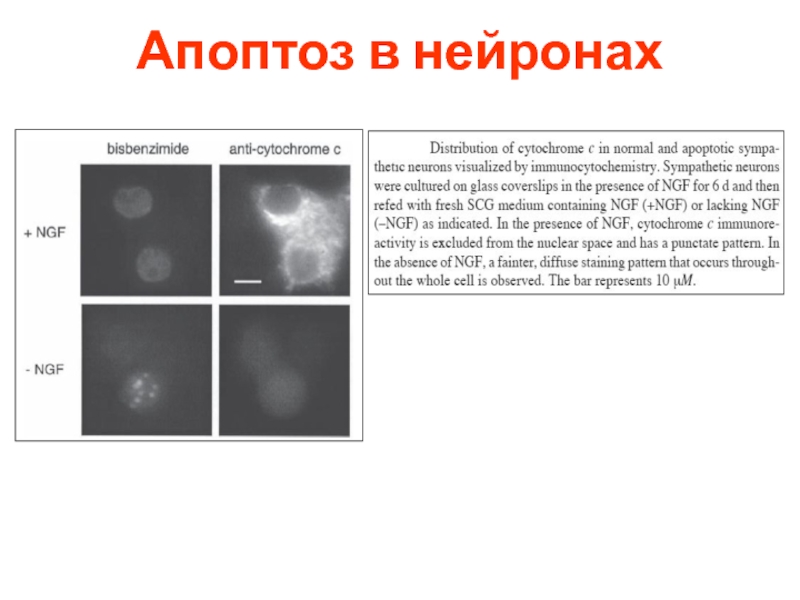
- 74. Апоптоз в нейронах
- 75. Апоптоз в нейронах
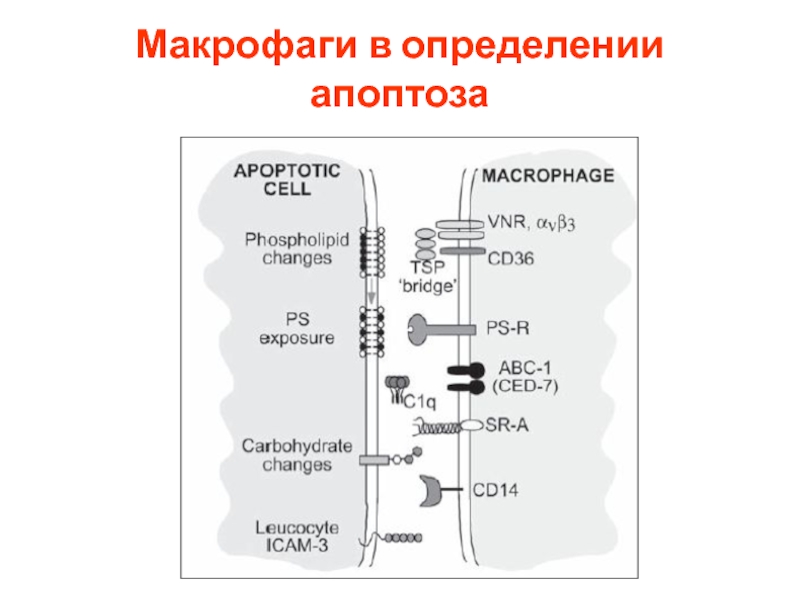
- 76. Макрофаги в определении апоптоза
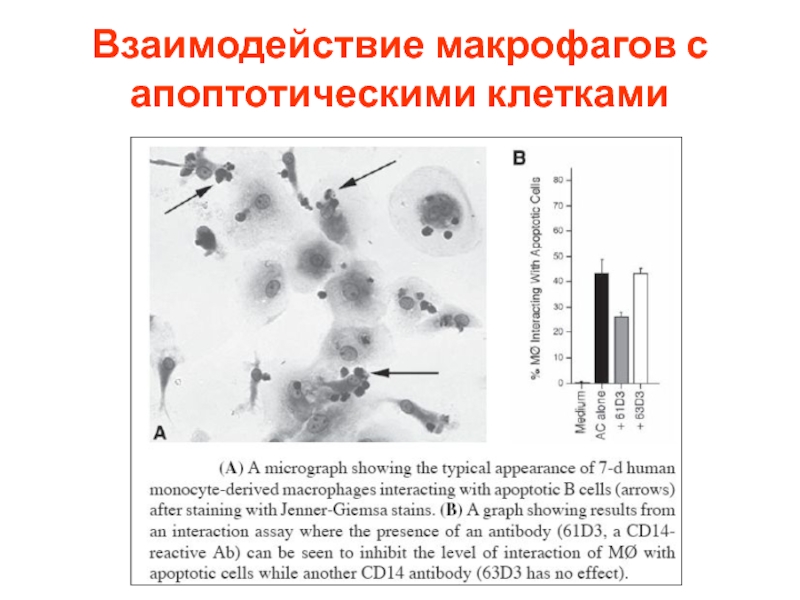
- 77. Взаимодействие макрофагов с апоптотическими клетками
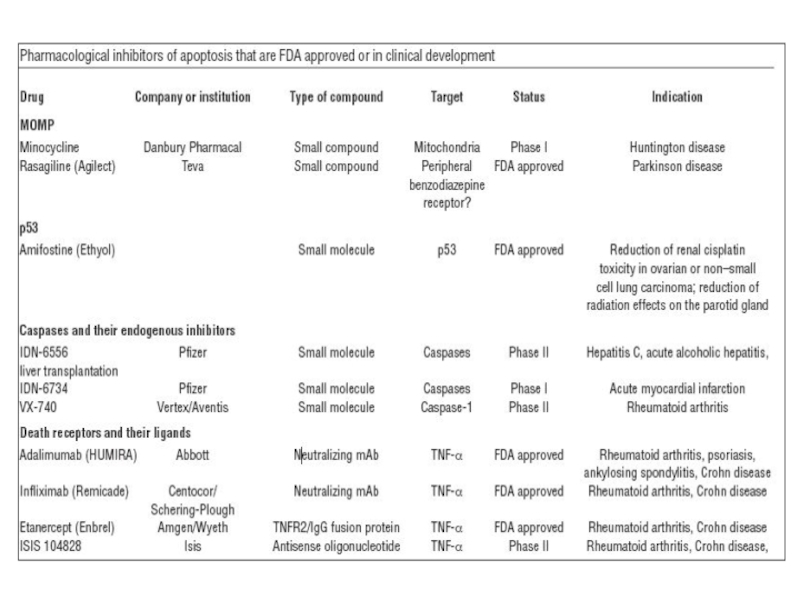
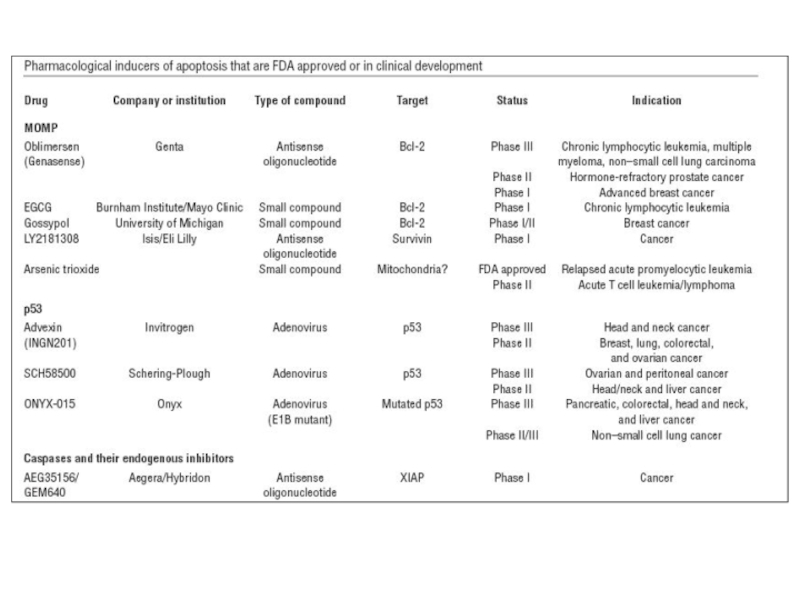
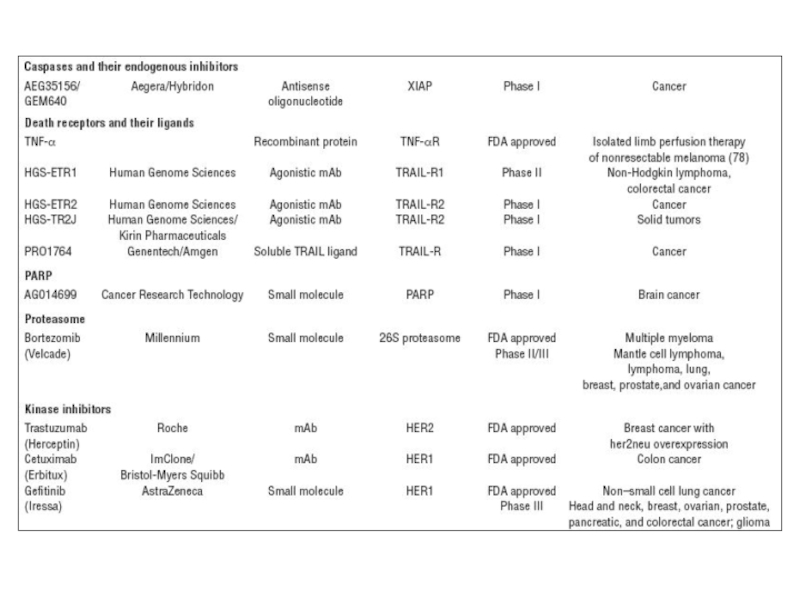
- 78. Терапевтические мишени для ингибирования апоптоза (доклиническая стадия)
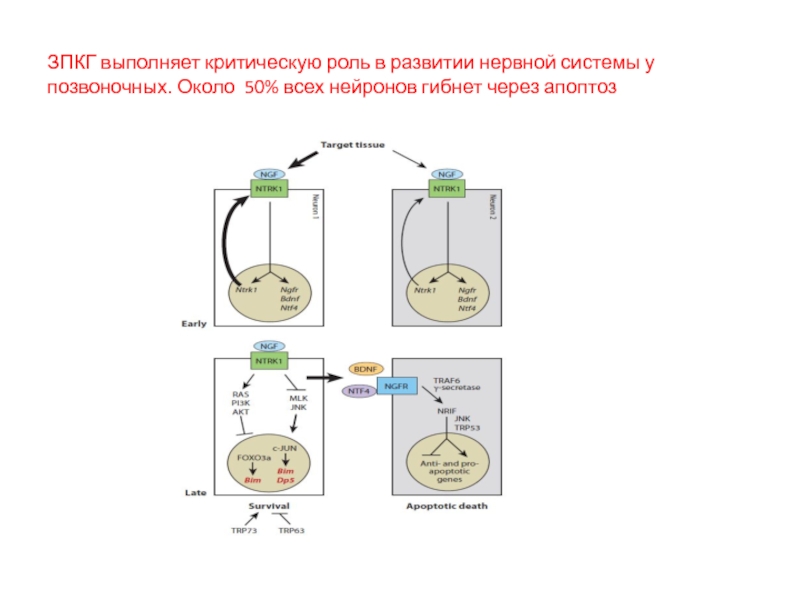
- 86. ЗПКГ выполняет критическую роль в развитии нервной
Слайд 2Во время жизни животных и человека наблюдается 2 типа ЗПКГ: апоптоз
Слайд 7Стадии апоптоза
1. Индукция. Изменения в клеточном окружении, приводящие к активации апоптоза
2. Исполнение. Клетка решает войти в апоптоз.
3. Дегенерация. События, связанные с конечным развертыванием клеточных процессов, позволяющих подойти клетке к точке, откуда нет возврата.
Слайд 8Индукторы и супрессоры апоптоза
Индукторы: дефицит ФР, глюкозы, УФ и гамма-излучение, перекись,
Супрессоры: экспрессия антиапоптотических генов сем. Bcl-2, MDR, теломеразы, ингибиторы синтеза РНК и белков, мут.р53 и др.
Слайд 11Лиганды и рецепторы
Лиганды: сем. гомотримерных лигандов TNF - FasL, TRAIL (Apo2L),
Рецепторы: FAS и др. рецепторы семейства TNF
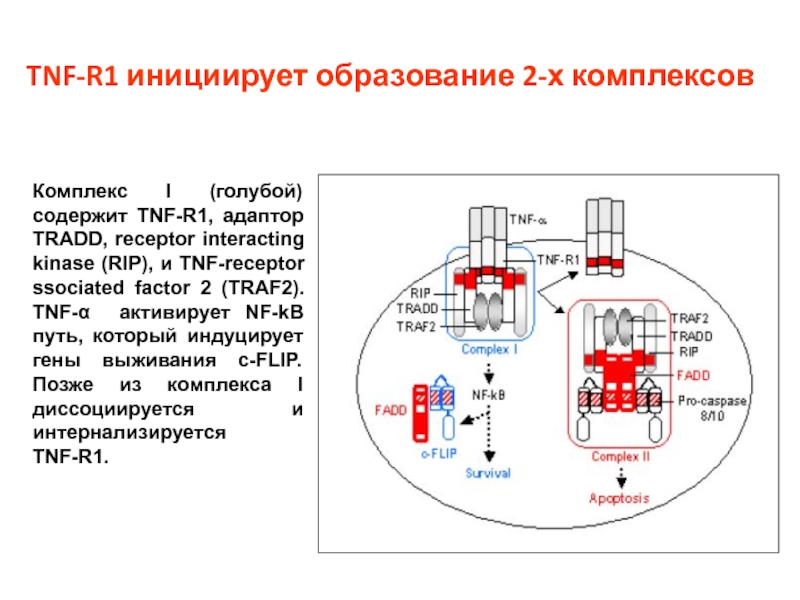
Слайд 18TNF-R1 инициирует образование 2-х комплексов
Комплекс I (голубой) содержит TNF-R1, адаптор TRADD,
TNF-R1.
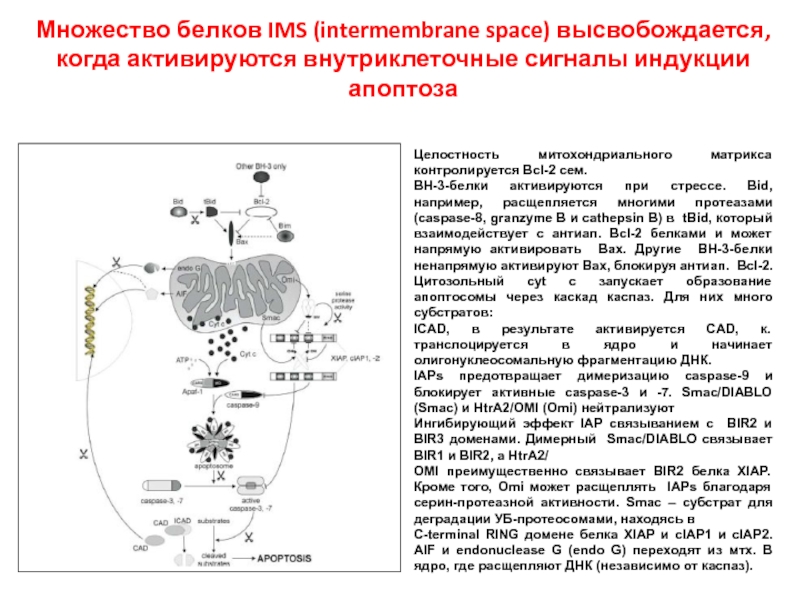
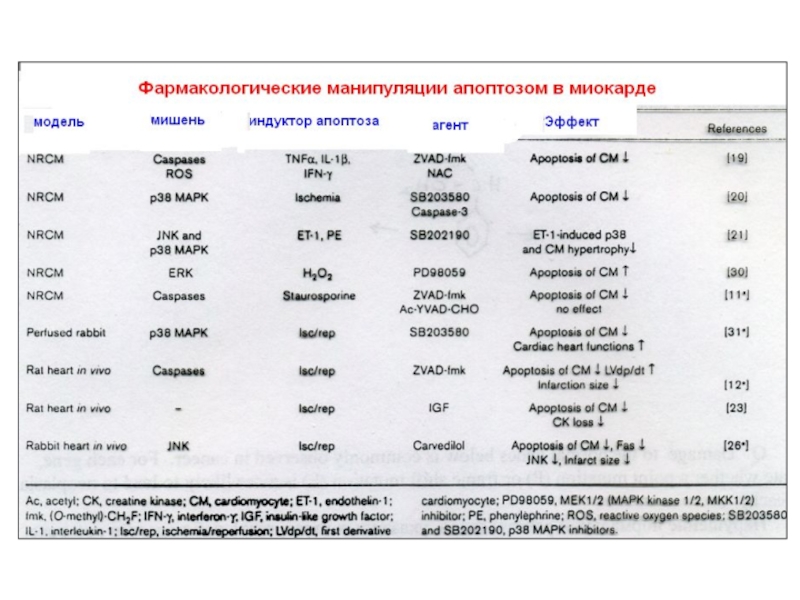
Слайд 26 Множество белков IMS (intermembrane space) высвобождается, когда активируются внутриклеточные сигналы индукции
Целостность митохондриального матрикса контролируется Bcl-2 сем.
BH-3-белки активируются при стрессе. Bid, например, расщепляется многими протеазами (caspase-8, granzyme B и cathepsin B) в tBid, который взаимодействует с антиап. Bcl-2 белками и может напрямую активировать Bax. Другие BH-3-белки ненапрямую активируют Bax, блокируя антиап. Bcl-2. Цитозольный cyt c запускает образование апоптосомы через каскад каспаз. Для них много субстратов:
ICAD, в результате активируется CAD, к. транслоцируется в ядро и начинает олигонуклеосомальную фрагментацию ДНК.
IAPs предотвращает димеризацию caspase-9 и блокирует активные caspase-3 и -7. Smac/DIABLO (Smac) и HtrA2/OMI (Omi) нейтрализуют
Ингибирующий эффект IAP связыванием с BIR2 и BIR3 доменами. Димерный Smac/DIABLO связывает BIR1 и BIR2, а HtrA2/
OMI преимущественно связывает BIR2 белка XIAP. Кроме того, Omi может расщеплять IAPs благодаря серин-протеазной активности. Smac – субстрат для деградации УБ-протеосомами, находясь в
C-terminal RING домене белка XIAP и cIAP1 и cIAP2. AIF и endonuclease G (endo G) переходят из мтх. В ядро, где расщепляют ДНК (независимо от каспаз).
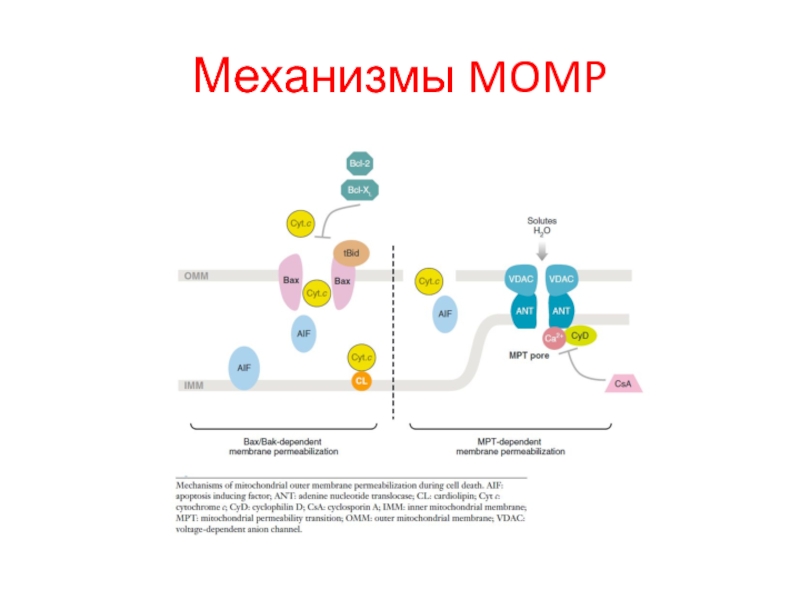
Слайд 33Регуляция мтх. апоптоза (2)
(a) Модель реостата. Обычно в клетке равновесие. Дисбаланс
(b) Модель нейтрализации анти-апоптотических белков. BH3-
only белки BID, BIM и PUMA вызывают mitochondrial outer membrane permeabilization, нейтрализуя анти-апоптотические белки.
Слайд 34Механизмы активации
про-апоптотических белков (1)
Модель прямой активации.
MOMP активируется через олигомеризацию
(b) Прямой активатор BH3-only белков (e.g. BIM and BID) индуцирует олигомеризацию BAX или BAK при отсутствии других белков
Слайд 35Механизмы активации
про-апоптотических белков (2)
(c) A subset of BH3-only proteins, the de-repressors/sensitizers,
2 protein. Following stress, a de-repressor/sensitizer BH3-only protein is induced, either by transcriptional up-regulation or by post-translational modification, and this
protein then binds to an anti-apoptotic BCL-2 protein, promoting the release of a sequestered, direct activator BH3-only protein. In this example, BIM is tonically
sequestered by MCL-1, and the induction of Noxa enables the release of BIM to engage MOMP. If cells constitutively harbor a sequestered direct activator protein, they are
referred to as being ‘primed for death’ or ‘BCL-2 addicted’. Not shown in this figure is the potential influence of Noxa-induced MCL-1 degradation after binding, which might
have important implications in maintaining anti-apoptotic levels to preserve outer mitochondrial membrane integrity [53]. (d) Cells are sensitized to undergo MOMP when
de-repressor/sensitizer BH3-only proteins are constitutively inhibiting anti-apoptotic BCL-2 proteins, and any future induction of BID or BIM cannot be tolerated. This scenario is referred to as ‘sensitized for death’. In this example, BCL-xL is inhibited by BAD, and the induction of BIM engages MOMP; in the absence of BAD expression, the MOMP signal would have been inhibited by BCL-xL.
Слайд 37Сборка каспаз
Общая структура прокаспаз и протеолитическое созревание расщеплением после остатков аспарагина.
В результате генерируется большая с (р20) и малая (р10) субъединицы, в каждой из которых формируется активный центр (кружок). Два гетеродимера складываются в тетрамер.
Слайд 40Caspase-2 инициаторная каспаза, наиболее эволюционно консервативная, действует upstream от митохондрий. Вовлечена
Слайд 41Доменная организация компонентов Death Inducing Signaling Complex (DISC), Fas, FADD, и
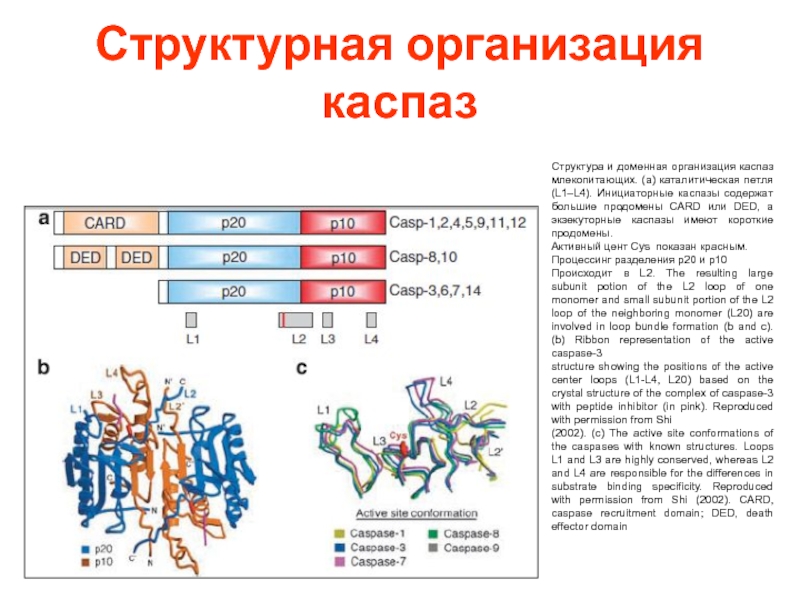
Слайд 42Структурная организация каспаз
Структура и доменная организация каспаз млекопитающих. (a) каталитическая петля
Активный цент Cys показан красным.
Процессинг разделения p20 и p10
Происходит в L2. The resulting large subunit potion of the L2 loop of one monomer and small subunit portion of the L2 loop of the neighboring monomer (L20) are involved in loop bundle formation (b and c). (b) Ribbon representation of the active caspase-3
structure showing the positions of the active center loops (L1-L4, L20) based on the crystal structure of the complex of caspase-3 with peptide inhibitor (in pink). Reproduced with permission from Shi
(2002). (c) The active site conformations of the caspases with known structures. Loops L1 and L3 are highly conserved, whereas L2 and L4 are responsible for the differences in substrate binding specificity. Reproduced with permission from Shi (2002). CARD, caspase recruitment domain; DED, death effector domain
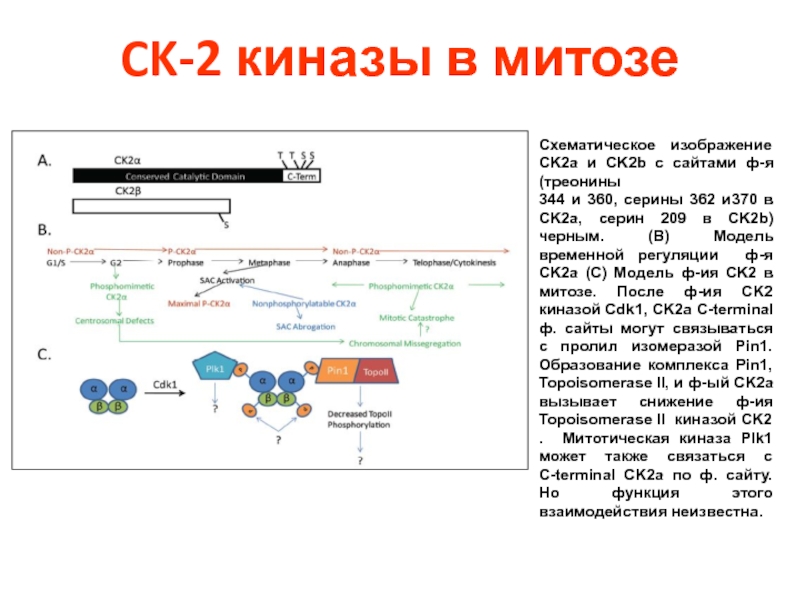
Слайд 45CK-2 киназы в митозе
Схематическое изображение CK2a и CK2b с сайтами ф-я
344 и 360, серины 362 и370 в CK2a, серин 209 в CK2b) черным. (B) Модель временной регуляции ф-я CK2a (C) Модель ф-ия CK2 в митозе. После ф-ия CK2 киназой Cdk1, CK2a C-terminal ф. сайты могут связываться с пролил изомеразой Pin1. Образование комплекса Pin1, Topoisomerase II, и ф-ый CK2a вызывает снижение ф-ия Topoisomerase II киназой CK2 . Митотическая киназа Plk1 может также связаться с C-terminal CK2a по ф. сайту. Но функция этого взаимодействия неизвестна.
Слайд 53Протеолиз и апоптоз
Conjugation of Ub to target proteins is mediated by
Ub to the target molecule. The E2 usually determines the type of Ub chain linkage, whereas E3 ligases provide substrate recognition. Ub chains are synthesized by
multiple rounds of Ub attachments, using internal lysine residues of Ub (shown here: K48 and K63) as conjugation sites. The different types of chains adopt different topologies with K48 being kinked, whereas K63-linked chains are linear. Depending on the type of modification, protein ubiquitylation has distinct cellular outcomes. Ub E3 ligases can also be subject to auto-modification to regulate their levels.